18.(12分)化学键的键能是指气态原子间形成1mol化学键时释放的能量。如H(g)+I(g)→H-I(g)+297KJ即H-I键的键能为297KJ·mol-1,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。一个化学反应一般都有旧化学键的破坏和新化学键的形成。
下表是一些键能数据(KJ·mol-1):
|
|
键能 |
|
键能 |
|
键能 |
|
键能 |
|
H-H |
436 |
Cl-Cl |
243 |
H-Cl |
432 |
H-O |
464 |
|
S=S |
255 |
H-S |
339 |
C-F |
427 |
C-O |
347 |
|
C-Cl |
330 |
C-I |
218 |
H-F |
565 |
|
|
回答下列问题:
(1)由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)_______(填“能”或“不能”)②非金属性越强的原子形成的共价键越牢固________(填“能”或“不能”)。能否从数据找出一些规律,请写出一条:___________________________________;试预测C-Br键的键能范围_________<C-Br键能<__________。
(2)由热化学方程式H2(g)+Cl2(g)→2HCl(g);△H=-185KJ·mol-1并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是_____________________________________________________,由热化学方程式2H2(g)+S2(s) →2H2S(g);△H=-224.5KJ·mol-1和表中数值可计算出1mol S2(s)气化时将________(填“吸收”或“放出”)_______KJ的热量。
(3)卤代烃RX在同样条件下发生碱性水解反应时,RF、RCl、RBr、RI(R相同)的反应活性由大到小的顺序是_________________________________。
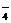 被还原为Mn2+,SO2被氧化成SO
被还原为Mn2+,SO2被氧化成SO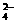 。
。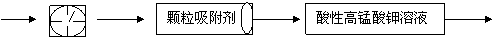


 ①其中: 或 表示密闭容器;
表示气体流速管(单位时间内通过
①其中: 或 表示密闭容器;
表示气体流速管(单位时间内通过
 气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒; 表示气体的流向。
气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒; 表示气体的流向。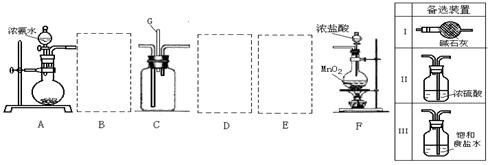
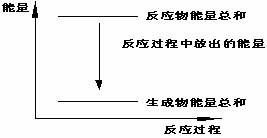 对于Zn(s)+H2SO4(l)=ZnSO4(l)+H2(g);ΔH <0 的化学反应下列叙述不正确的是
对于Zn(s)+H2SO4(l)=ZnSO4(l)+H2(g);ΔH <0 的化学反应下列叙述不正确的是 Fe(SCN)3+3KCl中加入KCl固体,红色变浅
Fe(SCN)3+3KCl中加入KCl固体,红色变浅