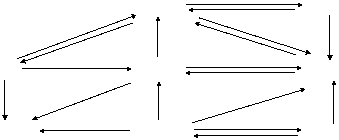
2.有关Al(OH)3沉淀的图象规律:

① 向一定量的AlCl3 溶液中逐滴加入NaOH 溶液至过量。 见 图(a)
有关离子方程式为: Al3+ + 3OH- = Al(OH)3 ↓
Al(OH)3 +OH - = AlO2― +2 H2O
② 向一定量的NaOH 溶液中逐滴加入AlCl3 溶液至过量。 见图 (b)
有关离子方程式为: Al3+ + 4OH- = AlO2― +2H2O
Al3+ + 3AlO2― + 6H2O = 4Al(OH)3 ↓
③ 向一定量的NaAlO2 溶液中逐滴加入稀盐酸溶液至过量。见图 (c)
有关离子方程式为: AlO2― +H+ +H2O = Al(OH)3 ↓
Al(OH)3 +3H+ = Al3+ +3H2O
④ 向一定量的盐酸 溶液中逐滴加入NaAlO2 溶液至过量。 见图 (d)
有关离子方程式为: AlO2― +4H+ = Al3+ +2H2O
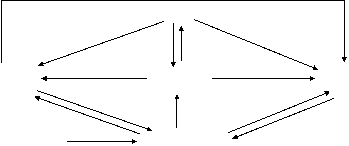
 铝三角关系
铝三角关系
例题精析
[例1]在一定量的饱和Na2CO3 溶液中通入少量CO2有无晶体析出?通入过量CO2 气体会产生什么现象?试分析原因是什么?
[例2]下列说法正确的是 ( )
A.常温下铝和浓H2SO4 、浓HNO3 均不反应
B.两份相同质量的铝粉,分别与足量的稀H2SO4和NaOH溶液反应,产生H2前者多
C.合金的熔点一般比组成它的各成分的熔点都低
D.将三份质量相同的镁粉分别放在纯氧气、CO2 二种气体中完全燃烧,在氧气中燃烧后所得固体的质量大。
[例3]在100mL0.5mol/L的AlCl3 溶液中,加入100mLNaOH溶液,得到0.78gAl(OH)3 沉淀。求所加NaOH 溶液的物质的量浓度。
[例4]在标准状况下进行甲、乙、丙三组实验,各取30mL同浓度的盐酸溶液,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下表:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量 g |
0.255 |
0.385 |
0.459 |
|
生成气体体积 mL |
280 |
336 |
336 |
试回答:
(1)盐酸一定过量的是(填序号) ,盐酸一定不足量的是 。
(2)要计算合金中的镁的质量分数,所提供数据中作计算依据的是 ,镁在合金中的质量分数为 。
(3)在丙组实验以后,向容器中加入一定体积的1mol/L的苛性钠溶液,可恰好使铝元素全部以偏铝酸根形式存在,并使镁离子刚好沉淀完全,则溶液中偏铝酸钠的物质的量为 mol所加苛性钠溶液的体积为 mL。
答案:1.通入少量CO2 无晶体析出,原因是生成NaHCO3 少,而NaHCO3可溶,所以无晶体析出。通入过量CO2 ,现象;溶液中有晶体析出. 原因:①反应全部生成NaHCO3 ,且NaHCO3的溶解度比Na2CO3小;②溶质的质量增加;③反应消耗水,使溶剂减少。
2.镁及其化合物间的转化关系:
 MgCl2
Mg
MgCl2
Mg
|
Mg Mg O Mg(OH)2
|
|||||
|
|||||
|
|||||
MgSO4 MgCO3 Mg(HCO3)2
|
|
|
|||
|
|||
|
|
KAl(SO4)2 Al(OH)3
巧思巧解:
5、(5分)
反应混和物A、B、C的物质的量浓度与时间t(秒)关系如表所示,该反应方程式为_______用A浓度变化表示200-800秒内反应的平均反应速度为___________摩/升·分。
|
T |
200 |
400 |
800 |
|
A |
1.45 |
1.28 |
1.00 |
|
B |
0.38 |
0.72 |
1.28 |
|
C |
0.095 |
0.18 |
0.32 |
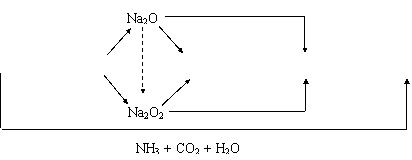
 Na
Na 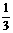 ,加入5克无水CuSO4恰好达到饱和,在剩下
,加入5克无水CuSO4恰好达到饱和,在剩下 的CuSO4溶液中,加入过量的铁粉,待反应完全后,测得溶液的质量为89.5克。
的CuSO4溶液中,加入过量的铁粉,待反应完全后,测得溶液的质量为89.5克。
 4NO2+O2的反应。反应5分钟后,N2O5减少到3.4摩。求
4NO2+O2的反应。反应5分钟后,N2O5减少到3.4摩。求 、
、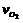 、
、 分别是多少?翰林汇
分别是多少?翰林汇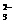 ====S4O
====S4O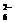 +2I-
+2I-