1、阳离子检验
|
离子 |
使用试剂 |
必须进行的操作 |
化学反应方程式 |
现象 |
|
H+ |
石芯试液 |
将石芯试液滴入被测试液 |
|
溶液变红 |
|
K+ |
|
用铂丝或光亮的铁丝蘸取试液,在无色灯焰上灼烧 |
焰色反应 |
隔蓝色的钴玻璃观察,火焰呈紫色 |
|
Mg2+ |
NaOH溶液NH4Cl溶液 |
取试液加入NaOH溶液即有白色沉淀,加过量的NaOH溶液沉淀不溶(与Al3+区别),但加NH4Cl 溶液沉淀溶解 |
2OH―+Mg2+ =Mg(OH)2 |
有白色沉淀生成,加NH4Cl 沉淀溶解 |
|
Al3+ |
NaOH溶液HCl溶液 |
在试液中逐滴加入NaOH 溶液,在产生的沉淀中HCl 或过量NaOH溶液,沉淀均溶解 |
Al3++3OH―=Al(OH)3 Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH-=AlO2―+2H2O |
有白色絮状沉淀生成,溶于HCl溶液或过量NaOH,不溶于水。 |
|
Fe2+ |
①NaOH溶液 ②KSCN溶液 |
①在试液中加入少量NaOH溶液②在试液中加入少量KSCN溶液,振荡观察,然后加入少量新配的氯水 |
①Fe2++2OH―=Fe(OH)2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 ②2Fe2++Cl2=2Fe3++2Cl― Fe3++SCN-=[Fe(SCN)]2+ |
①先生成白色沉淀,很快变为灰绿色,最后变为红褐色②KSCN溶液不变色,加氯水后变红色。 |
|
Ag+ |
稀HCl 、HNO3
、 氨水 |
在试液中先加少量稀盐酸,再加硝酸,再加氨水 |
Ag++Cl―=AgCl AgCl+2NH3·H2O = [Ag(NH3)2 ]+ +2H2O + Cl― |
生成白色沉淀,不溶于稀硝酸,但溶于氨水。 |
|
NH4+ |
NaOH溶液、红色的石芯试纸 |
在烧杯中加少量试液,加NaOH溶液,表面皿内贴一条湿润的红色石芯试纸,反盖在烧杯上,微热 |
NH4++OH― = NH3↑
+ H2O |
有刺激性气体放出,使湿润的红色石芯试纸变蓝。 |
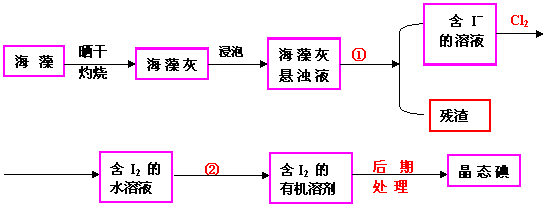 [例5 ]实验室里从海藻中提取碘的流程如下图:
[例5 ]实验室里从海藻中提取碘的流程如下图: 指出制取碘的过程中有关的实验操作名称:①__________②________________
指出制取碘的过程中有关的实验操作名称:①__________②________________