摘要:5.化学反应N2(g)+3H2(g)===2NH3(g)的能量变化如下图所示.该反应的热化学方程式是 ( ) A.N2(g)+3H2(g)===2NH3(l), ΔH=2(a-b-c)kJ·mol-1 B.N2(g)+3H2(g)===2NH3(g), ΔH=2(b-a)kJ·mol-1 C.N2(g)+H2(g)===NH3(l), ΔH=2(b+c-a)kJ·mol-1 D.N2(g)+H2(g)===NH3(g), ΔH=(a+b)kJ·mol-1 [解析] 本题考查热化学方程式的书写.由能量图象知.mol N2(g)和 mol H2(g)需要吸收a kJ的热量分解为1 mol N和3 mol H.而1 mol N和3 mol H放出b kJ的热量生成1 mol NH3(g),1 mol NH3(g)液化放出c kJ热量.因此由 mol N2(g)和 mol H2(g)生成1 mol NH3(l)的反应热为(a-b-c)kJ.故选A. [答案] A
网址:http://m.1010jiajiao.com/timu3_id_88817[举报]
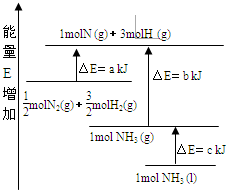 化学反应N2+3H2?2NH3的能量变化如图所示,E是正值,该反应的热化学方程式是( )
化学反应N2+3H2?2NH3的能量变化如图所示,E是正值,该反应的热化学方程式是( )| A、N2(g)+3H2(g)?2NH3(l);△H=2(a-b-c)kJ?mol-1 | ||||
| B、N2(g)+3H2(g)?2NH3(g);△H=2(b-a)kJ?mol-1 | ||||
C、
| ||||
D、
|
 化学反应N2+3H2→2NH3的能量变化如图所示,该反应的热化学方程式是( )
化学反应N2+3H2→2NH3的能量变化如图所示,该反应的热化学方程式是( )| A、N2(g)+H2(g)→NH3(1)-46 kJ | B、N2(g)+H2(g)→NH3(g)-454 kJ | C、N2(g)+3 H2(g)→2 NH3(g)+92 kJ | D、N2(g)+3 H2(g)→2 NH3(1)+431.3 kJ |
在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2 (g)+3H2 (g)═2NH3 (g);△H<0,反应中NH3的物质的量浓度变化情况如图1:

(1)根据上图,计算从反应开始到平衡时,平均反应速率v (NH3)为
(2)该反应的化学平衡常数表达式K
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
a.0.20mol/L b.0.12mol/L c.0.10mol/L d.0.08mol/L
(4)在一定条件下,合成氨反应已达化学平衡状态的是
A.3v(H2)(正)=2v(NH3)(逆) B.混合气体的密度保持不变
C.容器内压强保持不变 D.条件一定,混合气体的平均相对分子质量不再变化
E.单位时间内1mol N≡N键断裂的同时,有3mol H-H键生成
F.单位时间内生成了n mol N2的同时,减少了n mol NH3
(5)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡
(6)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol/L),请在图1中画出第5分钟末到此平衡时NH3浓度的变化曲线.
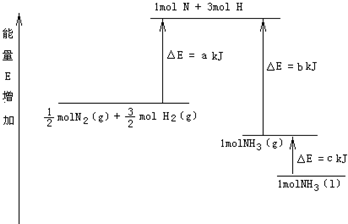
(7)已知化学反应N2+3H2=2NH3 的能量变化如图2所示,
①1mol N 和3mol H 生成1mol NH3(g)是
②
N2(g)+
H2(g)=NH3(g);△H=
③N2(g)和H2生成NH3(l)的热化学方程式为
查看习题详情和答案>>

(1)根据上图,计算从反应开始到平衡时,平均反应速率v (NH3)为
0.025
0.025
mol/(L?min).(2)该反应的化学平衡常数表达式K
=
| C2(NH3) |
| C (N2)C3(H2) |
=
,随温度升高,K值将| C2(NH3) |
| C (N2)C3(H2) |
减小
减小
(填“增大”、“减小”“不变”).(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
ac
ac
.a.0.20mol/L b.0.12mol/L c.0.10mol/L d.0.08mol/L
(4)在一定条件下,合成氨反应已达化学平衡状态的是
C、D、E
C、D、E
(填序号).A.3v(H2)(正)=2v(NH3)(逆) B.混合气体的密度保持不变
C.容器内压强保持不变 D.条件一定,混合气体的平均相对分子质量不再变化
E.单位时间内1mol N≡N键断裂的同时,有3mol H-H键生成
F.单位时间内生成了n mol N2的同时,减少了n mol NH3
(5)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡
向正反应方向
向正反应方向
移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数不变
不变
(填“增大”、“减小”或“不变”).(6)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol/L),请在图1中画出第5分钟末到此平衡时NH3浓度的变化曲线.
(7)已知化学反应N2+3H2=2NH3 的能量变化如图2所示,
①1mol N 和3mol H 生成1mol NH3(g)是
释放
释放
能量的过程(填“吸收”或“释放”).②
| 1 |
| 2 |
| 3 |
| 2 |
(a-b)kJ/mol
(a-b)kJ/mol
;③N2(g)和H2生成NH3(l)的热化学方程式为
N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1
N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1
.
 (2008?重庆)化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )
(2008?重庆)化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )