摘要:6.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是 ①CH3OH(g)+H2O(g)===CO2(g)+3H2(g),ΔH=+49.0 kJ·mol-1 ②CH3OH(g)+O2(g)===CO2(g)+2H2(g),ΔH=-192.9 kJ·mol-1 下列说法正确的是 ( ) A.CH3OH的燃烧热为192.9 kJ·mol-1 B.反应①中的能量变化如右图所示 C.CH3OH转变成H2的过程一定要吸收能量 D.根据②推知反应CH3OH(l)+O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 [解析] A项.燃烧热指在101 kPa时.1 mol物质完全燃烧.生成稳定氧化物时放出的热量.B项.反应①是吸热反应.而图中所示是放热反应.C项.由题意知.也可以放热.D项.由燃烧热的定义和反应②可推知. [答案] D
网址:http://m.1010jiajiao.com/timu3_id_88818[举报]
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是,下列说法正确的是( )
①CH3OH(g)+H2O(l)=CO2(g)+3H2(g);△H=+93.0kJ?mol-1
②CH3OH(g)+
O2(g)=CO2(g)+2H2(g);△H=-192.9kJ?mol-1.
①CH3OH(g)+H2O(l)=CO2(g)+3H2(g);△H=+93.0kJ?mol-1
②CH3OH(g)+
| 1 |
| 2 |
查看习题详情和答案>>
甲醇是一种很好的燃料,被称为21世纪的新型燃料.
工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:
CO(g)+2H2(g) CH3OH(g)△H1=-116kJ?molˉ1
CH3OH(g)△H1=-116kJ?molˉ1
(1)已知:CO(g)+
O2(g)=CO2(g)△H2=-283kJ?molˉ1
H2(g)+
O2(g)=H2O (g)△H3=-242kJ?molˉ1
1mol甲醇燃烧生成CO2和水蒸气放出
(2)在压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下在VL容器中制备甲醇.
①若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
A.则上表中剩余的实验条件数据:a=
B.根据反应特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变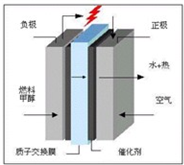 化的曲线图,请指明图中的压强P1=
化的曲线图,请指明图中的压强P1=
③100℃时,CH3OH(g) CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为
(用含a、V的代数式表示).
(3)科学家预言,燃料电池将是21世纪获得电力的重要途径,而甲醇燃料电池具备甲醇燃料容易携带、容易存储等优点,目前被认为将会替代传统的电池成为携带型设备的主要电源.右图是甲醇的质子交换膜型燃料电池模型.写出其电极反应式
正极:
负极:
查看习题详情和答案>>
工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)
 CH3OH(g)△H1=-116kJ?molˉ1
CH3OH(g)△H1=-116kJ?molˉ1(1)已知:CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
1mol甲醇燃烧生成CO2和水蒸气放出
651
651
kJ的热量.(2)在压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下在VL容器中制备甲醇.
①若容器容积不变,下列措施可增加甲醇产率的是
BD
BD
.A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.

| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
150
150
、b=1/3
1/3
.B.根据反应特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变
 化的曲线图,请指明图中的压强P1=
化的曲线图,请指明图中的压强P1=0.1
0.1
MPa.③100℃时,CH3OH(g)
 CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为| 4a2 |
| V2 |
| 4a2 |
| V2 |
(用含a、V的代数式表示).
(3)科学家预言,燃料电池将是21世纪获得电力的重要途径,而甲醇燃料电池具备甲醇燃料容易携带、容易存储等优点,目前被认为将会替代传统的电池成为携带型设备的主要电源.右图是甲醇的质子交换膜型燃料电池模型.写出其电极反应式
正极:
3O2+12e-+12H+→6H2O
3O2+12e-+12H+→6H2O
负极:
2CH4O-12e-+2H2O→12H++2CO2
2CH4O-12e-+2H2O→12H++2CO2
.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ?mol-1
②CH3OH(g)+
O2(g)═CO2(g)+2H2(g);△H=-192.9kJ?mol-1
下列说法正确的是( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ?mol-1
②CH3OH(g)+
| 1 |
| 2 |
下列说法正确的是( )
 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ?mol -1
②CH3OH(g)+
| 1 |
| 2 |
下列说法正确的是( )
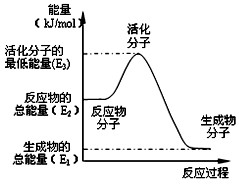
| A、反应②中的能量变化如图所示,则△H2=E1-E3 |
| B、CH3OH的燃烧热△H=-192.9 kJ?mol -1 |
| C、H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收能量 |
| D、根据②推知:在25℃,101 kPa时,1mol CH3OH(g)燃烧生成CO2和H2O(l)放出的热量应大于192.9 kJ |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0 kJ?mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ?mol-1
下列说法正确的是( )
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0 kJ?mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ?mol-1
下列说法正确的是( )
A、反应①中的能量变化如图所示 | ||
| B、CH3OH的燃烧热为192.9kJ?mol-1 | ||
| C、CH3OH转变成H2的过程一定要吸收能量 | ||
D、根据②推知反应:CH3OH(l)+
|