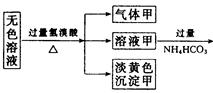
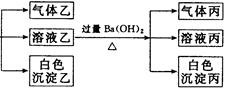
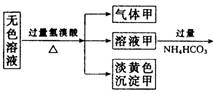
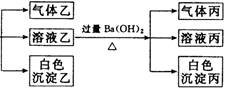
摘要:14.某无色溶液.其中有可能存在的离子如下:Ag+.Na+.Ba2+.Al3+.AlO.S2-.CO.SO.SO.现取该溶液进行有关实验.实验结果如图所示: 请回答下列问题: (1)沉淀甲是 .生成沉淀甲的离子方程式为 . (2)沉淀乙是 .由溶液甲生成沉淀乙的离子方程式为 . (3)沉淀丙是 .如何用一化学实验来确定其成分? . (4)气体甲的成分有哪几种可能? . (5)综合上述信息.可以肯定存在的离子有 . [解析] 首先分析4种阳离子与5种阴离子的共存关系.因为Ag+与所有的5种阴离子不可大量共存.立即排除Ag+.从而将沉淀甲锁定为S.S沉淀生成的条件需要SO在酸性条件下与S2-反应.进一步可推得Ba2+不存在.再得沉淀乙只能是Al元素引起的沉淀Al(OH)3.对沉淀丙的分析:可由溶液乙的成分出发.乙溶液中的阴离子有过量余下的HCO及可能原溶液中SO.故丙沉淀为BaCO3或BaCO3.BaSO4两者的混合物.对Na+的判断可从溶液电中性的角度思考.然后利用题给反应信息再结合离子共存关系.则能顺利解答. [答案] (1)S 2S2-+SO+6H+===3S↓+3H2O 3 Al3++3HCO===Al(OH)3↓+3CO2↑ (3)BaCO3或BaCO3.BaSO4两者的混合物 在所得沉淀中加入足量稀盐酸.若沉淀不能全部溶解说明其中有BaSO4.如全溶解则为BaCO3 (4)①CO2 ②H2S ③SO2 ④H2S和CO2 ⑤SO2和CO2 (5)S2-.SO.AlO和Na+
网址:http://m.1010jiajiao.com/timu3_id_88812[举报]
某无色溶液,其中有可能存在的离子如下:Ag+、Na+?、Ba2+?、Al3+、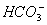 、S2-、
、S2-、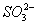 、
、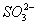 、
、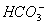 。现取该溶液进行有关实验,实验结果如图所示:
。现取该溶液进行有关实验,实验结果如图所示:
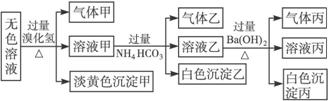
请回答下列问题:(1)沉淀甲是________,生成沉淀甲的离子方程式为________________。
(2)沉淀乙是_______,由溶液甲生成沉淀乙的离子方程式为______________________。
(3)沉淀丙是_______,如何用一化学实验来确定其成分?________________________。
(4)气体甲的成分有哪几种可能?___________________________。
(5)综合上述信息,可以肯定存在的离子有__________________________。
查看习题详情和答案>>某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO
、S2-、CO32-、SO32-、SO
.现取该溶液进行有关实验,实验结果如下图所示:

(1)沉淀甲是
(2)沉淀乙是
(3)沉淀丙是
(4)综合上述信息,可以肯定存在的离子有
查看习题详情和答案>>
- 2 |
2- 4 |

(1)沉淀甲是
S
S
,生成沉淀的离子方程式2S2-+SO32-+6H+=3S↓+3H2O
2S2-+SO32-+6H+=3S↓+3H2O
.(2)沉淀乙是
Al(OH)3
Al(OH)3
,由溶液甲生成沉淀乙的离子方程式Al3++3HCO3-=Al(OH)3↓+3CO2↑
Al3++3HCO3-=Al(OH)3↓+3CO2↑
.(3)沉淀丙是
BaCO3,可能有BaSO4; 在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3 外还有BaSO4;若全部溶解,则仅有BaCO3.
BaCO3,可能有BaSO4; 在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3 外还有BaSO4;若全部溶解,则仅有BaCO3.
.(4)综合上述信息,可以肯定存在的离子有
Na+、S2-、SO32-、AlO2-
Na+、S2-、SO32-、AlO2-
.某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、CO32-、SiO32-、SO32-、SO42-.现取该溶液进行有关实验,实验结果如图所示:下列说法正确的是( )
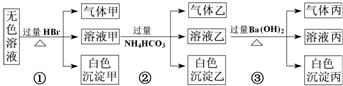

| A、有实验①可知,气体甲一定是纯净物 | B、有实验②可知,气体乙一定是CO2,沉淀乙是Al(OH)3 原溶液中肯定含有Al3+ | C、有实验③可知,气体丙是NH3,沉淀丙一定有BaCO3,可能有BaSO4 | D、原溶液中肯定含有SiO32-、AlO2-、Na+、CO32-,不能确定是否含有SO32-、SO42- |