摘要:2.外界条件对化学平衡的影响: (1) 化学平衡移动的原因及平衡移动方向的判断 (2)外界条件对化学平衡的影响及勒夏特列原理 温度--在其它条件不变的情况下.增大反应物浓度或减少生成物浓度.平衡向正反应方向移动,增大生成物浓度或减少反应物浓度.平衡向逆反应方向移动.(即在其它条件不变的情况下.改变某一物质的浓度.则平衡向着减弱该物质浓度改变的方向移动.) 注意:①增减固体或纯液体的量.对化学反应速率无影响.对化学平衡也无影响.②增大平衡体系中某一反应物的浓度.可以提高另一反应物的转化率. 压强--在其它条件不变的情况下.对于有气体参加的反应.增大压强.平衡向气体体积减小的方向移动,减小压强.平衡向气体体积增大的方向移动.(即在其它条件不变的情况下.对于有气体参加的反应.改变压强.则平衡向着减弱压强改变的方向移动.) 注意:①必须有气体参加的平衡体系,②改变压强实际上是通过等倍数改变体系中各物质的浓度来影响化学平衡的.③充入与反应无关的气体时对化学平衡的影响: 外界条件 aA a+b=c a+b>c 速率变化 情 况 平衡移动 情 况 速率变化 情 况 平衡移动 情 况 恒温恒容 不 变 化 不 移 动 不 变 化 不 移 动 恒温恒压 速率等倍数减小 不 移 动 速率等倍数减小 逆向移动 温度--在其它条件不变的情况下.升高温度.平衡向气体吸热反应的方向移动,降低温度.平衡向放热反应的方向移动.(即在其它条件不变的情况下.改变温度.则平衡向着减弱温度改变的方向移动.) 催化剂--加入催化剂.能够同等程度的加快正逆反应的速率.平衡不移动. 勒夏特列原理--如果改变影响平衡的一个条件.则平衡向着能够减弱条件改变的方向移动. 注意:①适用范围--所有的平衡体系(可逆反应.溶解.电离.水解.络合等),②对于不能使化学平衡发生移动的外界条件.不能用勒夏特列原理(如催化剂.合成氨对温度的选择.反应前后气体体积相等的反应改变压强),③平衡移动的结果是减弱条件的改变.而不是消除条件的改变.
网址:http://m.1010jiajiao.com/timu3_id_81839[举报]
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡的影响规律图象,其图象和实验结论表达正确的是 ( )

注:①中的反应式为:A(g)+3B(g) 2C(g);②中的反应式为:A(g)+B(g)
2C(g);②中的反应式为:A(g)+B(g) 2C(g);
2C(g);
③中的反应式为:A(g)+3B(g) 2C(g);④中的反应式为:A(g)+B(g)
2C(g);④中的反应式为:A(g)+B(g) 2C(g)
2C(g)

注:①中的反应式为:A(g)+3B(g)
 2C(g);②中的反应式为:A(g)+B(g)
2C(g);②中的反应式为:A(g)+B(g) 2C(g);
2C(g);③中的反应式为:A(g)+3B(g)
 2C(g);④中的反应式为:A(g)+B(g)
2C(g);④中的反应式为:A(g)+B(g) 2C(g)
2C(g)
查看习题详情和答案>>
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡的影响规律图象,其图象和实验结论表达正确的是 ( )
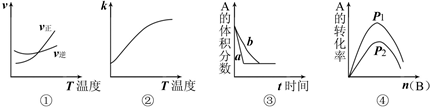
注:①中的反应式为:A(g)+3B(g)

2C(g);②中的反应式为:A(g)+B(g)

2C(g);
③中的反应式为:A(g)+3B(g)

2C(g);④中的反应式为:A(g)+B(g)

2C(g)
查看习题详情和答案>>

注:①中的反应式为:A(g)+3B(g)

2C(g);②中的反应式为:A(g)+B(g)

2C(g);
③中的反应式为:A(g)+3B(g)

2C(g);④中的反应式为:A(g)+B(g)

2C(g)
| A.①是其它条件一定时,反应速率随温度变化的图象,正反应△H<0 |
| B.②是其它条件一定时,化学平衡常数随温度的变化图象,正反应△H<0 |
| C.③是在有无催化剂存在下建立的平衡过程图象,a是使用催化剂的曲线 |
| D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2 |
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡的影响规律图象,其图象和实验结论表达正确的是 ( )
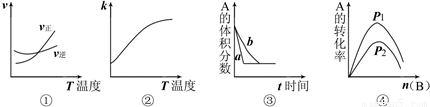
注:①中的反应式为:A(g)+3B(g) 2C(g);②中的反应式为:A(g)+B(g)
2C(g);②中的反应式为:A(g)+B(g) 2C(g);
2C(g);
③中的反应式为:A(g)+3B(g) 2C(g);④中的反应式为:A(g)+B(g)
2C(g);④中的反应式为:A(g)+B(g) 2C(g)
2C(g)
A.①是其它条件一定时,反应速率随温度变化的图象,正反应△H<0
B.②是其它条件一定时,化学平衡常数随温度的变化图象,正反应△H<0
C.③是在有无催化剂存在下建立的平衡过程图象,a是使用催化剂的曲线
D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2
查看习题详情和答案>>

注:①中的反应式为:A(g)+3B(g)
 2C(g);②中的反应式为:A(g)+B(g)
2C(g);②中的反应式为:A(g)+B(g) 2C(g);
2C(g);③中的反应式为:A(g)+3B(g)
 2C(g);④中的反应式为:A(g)+B(g)
2C(g);④中的反应式为:A(g)+B(g) 2C(g)
2C(g)A.①是其它条件一定时,反应速率随温度变化的图象,正反应△H<0
B.②是其它条件一定时,化学平衡常数随温度的变化图象,正反应△H<0
C.③是在有无催化剂存在下建立的平衡过程图象,a是使用催化剂的曲线
D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2
查看习题详情和答案>>
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡的影响规律图象,其图象和实验结论表达正确的是 ( )
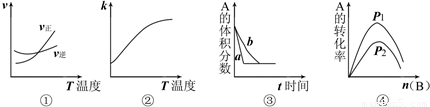
注:①中的反应式为:A(g)+3B(g) 2C(g);②中的反应式为:A(g)+B(g)
2C(g);②中的反应式为:A(g)+B(g) 2C(g);
2C(g);
③中的反应式为:A(g)+3B(g) 2C(g);④中的反应式为:A(g)+B(g)
2C(g);④中的反应式为:A(g)+B(g) 2C(g)
2C(g)
A.①是其它条件一定时,反应速率随温度变化的图象,正反应△H<0
B.②是其它条件一定时,化学平衡常数随温度的变化图象,正反应△H<0
C.③是在有无催化剂存在下建立的平衡过程图象,a是使用催化剂的曲线
D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2
查看习题详情和答案>>

注:①中的反应式为:A(g)+3B(g)
 2C(g);②中的反应式为:A(g)+B(g)
2C(g);②中的反应式为:A(g)+B(g) 2C(g);
2C(g);③中的反应式为:A(g)+3B(g)
 2C(g);④中的反应式为:A(g)+B(g)
2C(g);④中的反应式为:A(g)+B(g) 2C(g)
2C(g)A.①是其它条件一定时,反应速率随温度变化的图象,正反应△H<0
B.②是其它条件一定时,化学平衡常数随温度的变化图象,正反应△H<0
C.③是在有无催化剂存在下建立的平衡过程图象,a是使用催化剂的曲线
D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2
查看习题详情和答案>>
科学研究表明,不少化学反应都具有可逆性,即正向反应和逆向反应都能同时进行.
(1)一定条件下,当可逆反应的正反应速率与逆反应速率
(2)外界条件的变化有可能破坏原有的平衡状态,并在新的条件下建立新平衡,可逆反应中旧平衡破坏和新平衡建立的过程叫化学平衡的移动.化学平衡移动的方向由条件改变时正反应速率[v(正)]和逆反应速率[v(逆)]的相对大小决定.当v(正)>v(逆)时,平衡向右(正反应方向)移动,当v(正)<v(逆)时,平衡向左(逆反应方向)移动,当v(正)=v(逆)时,平衡不移动.勒夏特列从大量实验事实中总结出平衡移动的规律(勒夏特列原理):如果改变影响平衡的一个条件,平衡就向着能够减弱这种改变的方向移动.一定条件下可逆反应2A(g)+B(s) 2C(g);△H<0达到平衡.现只改变下列一个条件时,试依据勒夏特列原理,判断平衡移动的方向.(填向左移动、向右移动、不移动)
2C(g);△H<0达到平衡.现只改变下列一个条件时,试依据勒夏特列原理,判断平衡移动的方向.(填向左移动、向右移动、不移动)
1增大C的浓度
(3)已知使用催化剂不能使化学平衡发生移动,试从反应速率的角度说明催化剂不能使化学平衡发生移动的原因
查看习题详情和答案>>
(1)一定条件下,当可逆反应的正反应速率与逆反应速率
相等
相等
时,反应物与生成物的浓度保持不变
保持不变
,达到表面上静止的一种“平衡状态”,这种状态叫化学平衡状态.(2)外界条件的变化有可能破坏原有的平衡状态,并在新的条件下建立新平衡,可逆反应中旧平衡破坏和新平衡建立的过程叫化学平衡的移动.化学平衡移动的方向由条件改变时正反应速率[v(正)]和逆反应速率[v(逆)]的相对大小决定.当v(正)>v(逆)时,平衡向右(正反应方向)移动,当v(正)<v(逆)时,平衡向左(逆反应方向)移动,当v(正)=v(逆)时,平衡不移动.勒夏特列从大量实验事实中总结出平衡移动的规律(勒夏特列原理):如果改变影响平衡的一个条件,平衡就向着能够减弱这种改变的方向移动.一定条件下可逆反应2A(g)+B(s)
 2C(g);△H<0达到平衡.现只改变下列一个条件时,试依据勒夏特列原理,判断平衡移动的方向.(填向左移动、向右移动、不移动)
2C(g);△H<0达到平衡.现只改变下列一个条件时,试依据勒夏特列原理,判断平衡移动的方向.(填向左移动、向右移动、不移动)1增大C的浓度
向左
向左
②减小A的浓度向左
向左
③增大压强不移动
不移动
(3)已知使用催化剂不能使化学平衡发生移动,试从反应速率的角度说明催化剂不能使化学平衡发生移动的原因
催化剂同时等幅改变正逆反应速率,条件变化后正逆反应速率依然相等
催化剂同时等幅改变正逆反应速率,条件变化后正逆反应速率依然相等
.