网址:http://m.1010jiajiao.com/timu3_id_81840[举报]
在T℃条件下,向1L固定体积的密闭容器M中加入2mol X和1 mol Y,发生如下反应: 2X(g) + Y(g) a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)、化学计量数a的值为 ;此反应的逆反应△S__________0 (填﹤,﹥,﹦)。
(2)、下列说法中能说明该反应达到了化学平衡状态的是 。
A、容器内压强一定 B、v(X)正=2v (Y)逆
C、容器内Z分子数一定 D、容器内气体的质量一定
E、容器内气体的密度一定 F:X、Y、Z、W的浓度之比为2∶1∶a∶1
(3)、维持温度不变,若起始时向该容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应);与之是等效平衡的是______________。
A.2mol X、1mol Y、1molAr B.a mol Z、1mol W
C.1molX、0.5mol Y、0.5a mol Z、0.5 mol W D.2 mol X、1mol Y、1mol Z
(4)、维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了15%,则反应中放出的热量为 kJ。
(5)、维持T℃条件不变,若在一个和原容器体积相等的恒压容器N 中,加入2 mol X和1 molY发生如上反应并达平衡,则 (选填M或N)容器中的反应先达到平衡状态,容器中X的质量分数M N(选填>、<、=符号)。
(6)已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 150 | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 | 0.21 |
试回答下列问题:
若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为 ℃。
查看习题详情和答案>>
(1)若在恒温恒容的容器内进行反应C(s)+H2O(g)?CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有
a.容器内的压强保持不变
b.容器中H2浓度与CO浓度相等
c.容器中混合气体的密度保持不变
d.CO的生成速率与H2的生成速率相等
(2)CO一空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2.该电池负极的电极反应式为
(3)一定条件下,CO与H2可合成甲烷,反应方程式为:CO(g)+3H2(g)?CH4(g)+H2O(g)
①一定条件下,该反应能够自发进行的原因是
②已知H2(g)、CO(g)和 CH4(g)的燃烧热分别为285.8kJ?mol-1、283.0kJ?mol-1和890,0kJ?mol-1.
写出CO与H2反应生成CH4和CO2的热化学方程式:
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,反应方程式为:CH3OH(g)+CO(g)
| 催化剂 | △ |
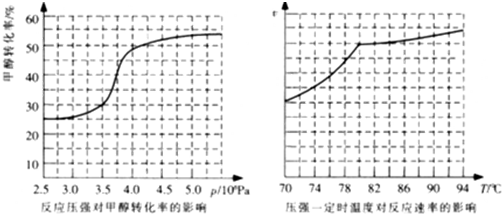
①从反应压强对甲醇转化率的影响“效率“看,工业制取甲酸甲酯应选择的压强是
②实际工业生产中采用的温度是80℃,其理由是
 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是_______(填字母,下同)。
A.向装置中充入N2
B.向装置中充入过量的SO2
C.向装置中充入O2
D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2 和2mol O2 及固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g) ,下列说法正确的是___________
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
⑶生产中在550 ℃时,将2.0 mol SO2和1.0 mol O2置于 5 L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。反应达平衡后,体系总压强为
0.10 M Pa。试计算反应 2SO3
 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。 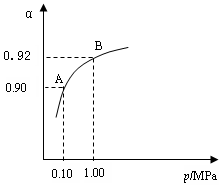
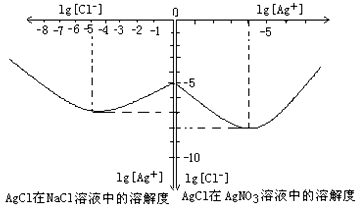
①由图知该温度下AgCl的溶度积常数为__________________________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:__________________________
 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是_______(填字母,下同)。
A.向装置中充入N2
B.向装置中充入过量的SO2
C.向装置中充入O2
D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2 和2mol O2 及固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g) ,下列说法正确的是___________
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
⑶生产中在550 ℃时,将2.0 mol SO2和1.0 mol O2置于 5 L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。反应达平衡后,体系总压强为
0.10 M Pa。试计算反应 2SO3
 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。 
①由图知该温度下AgCl的溶度积常数为__________________________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:__________________________

(1)甲烷在一定条件下与水反应可得合成气,该反应中每转移1.2mol电子,所得合成气在表况下的体积为__________________L。
(2)合成气在合成氨气时需除去CO,可利用以下反应:CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)  H=-41.16kJ/mol 对于该反应有关表述正确的是________________。
H=-41.16kJ/mol 对于该反应有关表述正确的是________________。 a.其他条件不变,缩小体系体积增大压强时反应速率不变,所以平衡不移动
b.绝热条件下,若测得该体系温度不再改变,则反应处于平衡状态
c.温度升高,该反应平衡常数增大
d.为提高CO转化率,可适当增加水蒸气用量
某温度下,H2O和CO按体积比5:l充入某恒容反应器,平衡时测得CO与CO2体积比l:9,则该条件下的平衡常数为____________ (保留两位有效数字)
(3)为除去(2)中生成的CO2,可用碳酸钾溶液吸收,常温下pH=10的碳酸钾溶液中水电离的OH- 的物质的量浓度为___________,碳酸氢钾溶液中离子浓度大小顺序为 ____________
(4)CO2和NH3在一定条件下反应生成尿素[CO(NH2)2]:CO2(g)+2NH3(1)=H2O(1)+CO(NH2)2(1),CO2的转化率随温度变化曲线如下,则该反应
 H __________0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理______________。
H __________0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理______________。 