网址:http://m.1010jiajiao.com/timu3_id_81595[举报]
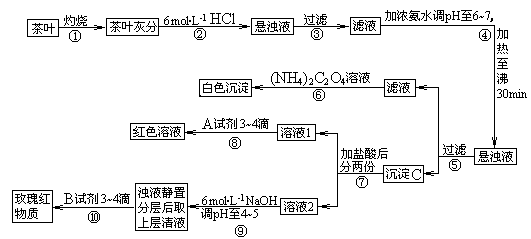
【查阅部分资料】草酸铵〔(NH4)2C2O4〕属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、Al3+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。

试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是____________________________________________________。
(2)写出检验Ca2+的离子方程式________________________________________________。
(3)写出沉淀C所含主要物质的化学式____________。
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式______________________________。
(5)步骤⑨的作用是_________________,猜测步骤⑩的目的是______________________。
查看习题详情和答案>>茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
【查阅部分资料】:草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙(CaC2O4)难溶于水;Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 ____ 。
(2)写出检验Ca2+的离子方程式 ___ 。
(3)步骤⑤中需要使用的主要玻璃仪器有 。
写出沉淀C所含主要物质的化学式 。
(4)写出步骤⑧用A试剂生成血红色溶液的离子方程式 。
(5)步骤⑨的作用是 ,发生反应的离子方程式 。
查看习题详情和答案>>茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素。
【查阅部分资料】:草酸铵[(NH4)2C2O4]属于弱电解质;草酸钙(CaC2O4)难溶于水;Ca2+、A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。

试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 ____ 。
(2)写出检验Ca2+的离子方程式 ___ 。
(3)步骤⑤中需要使用的主要玻璃仪器有 。
写出沉淀C所含主要物质的化学式 。
(4)写出步骤⑧用A试剂生成血红色溶液的离子方程式 。
(5)步骤⑨的作用是 ,发生反应的离子方程式 。
查看习题详情和答案>>(14分)茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、A1、Fe三种元素。
【资料查询】:草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、
A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 。
(2)步骤③操作中用到的玻璃仪器有 。
(3)写出步骤⑥中检验Ca2+存在的离子方程式 。
(4)写出沉淀C所含主要物质的化学式 。
(5)写出步骤⑧中选用A试剂的化学式 。
(6)步骤⑨的作用是 ,
猜测步骤⑩的目的是 。
查看习题详情和答案>>
(14分)茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、A1、Fe三种元素。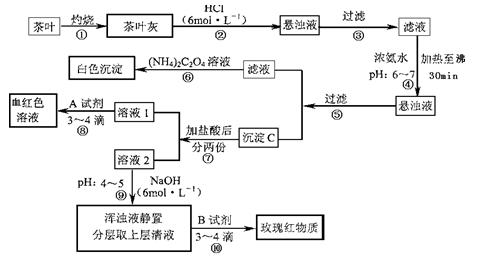
【资料查询】: 草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、
草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、
A13+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 。
(2)步骤③操作中用到的玻璃仪器有 。
(3)写出步骤⑥中检验Ca2+存在的离子方程式 。
(4)写出沉淀C所含主要物质的化学式 。
(5)写出步骤⑧中选用A试剂的化学式  。
。
(6)步骤⑨的作用是 ,
猜测步骤⑩的目的是 。