13.已知:以铜作催化剂,用空气氧化醇制取醛,事实上是空气先与铜反应生成氧化铜,热的氧化铜再氧化醇生成醛。某实验室中用甲醇、水、空气和铜粉(或氧化铜)制取甲醛溶液。下表给出甲醇、甲醛的沸点和水溶性:
|
|
沸点/℃ |
水溶性 |
|
甲 醇 |
65 |
与水混溶 |
|
甲 醛 |
-21 |
与水混溶 |
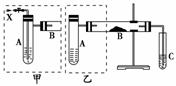 下图是两个同学设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如图甲、乙所示:
下图是两个同学设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如图甲、乙所示:
请回答下列问题:
(1)在仪器组装完成后,加装试剂前必须要进行的操作是________________。
(2)若按甲装置进行实验,则通入A中的X是________,B中发生反应的化学方程式为__________________。
(3)若按乙装置进行实验,则B中应装入的物质是________。
(4)C中应装入的试剂是________。
(5)两套装置中都需要加热的仪器有________(填“A”、“B”或“C”)。
(6)若欲得到较浓的甲醛溶液,你认为选用哪套装置较好,________(填“甲”或“乙”)。
(7)验证实验后C中含有甲醛,所用试剂是________。
解析:对比甲、乙两装置,可知通入A中的X为空气,可以通过持续加入来提供O2,所以B中加入的铜粉主要起催化作用。而乙中无法补充空气(提供O2),因此应在B中加入较多的CuO与甲醇反应。
答案:(1)检查装置的气密性 (2)空气 2CH3OH+O2Cu△2HCOH+2H2O (3)CuO (4)H2O (5)AB (6)甲 (7)新制Cu(OH)2悬浊液(或银氨溶液)
9.实验室里需要配制480 mL 0.1 mol·L-1的硫酸铜溶液,下列实验方案及实验操作正确的是( )
|
选项 |
容量瓶容积 |
溶质质量 |
实验操作 |
|
A |
480 mL |
硫酸铜:7.68
g |
加入500 mL水 |
|
B |
480 mL |
胆矾:12.0 g |
配成500 mL溶液 |
|
C |
500 mL |
硫酸铜:8.0 g |
加入500 mL水 |
|
D |
500 mL |
胆矾:12.5
g |
配成500 mL溶液 |
解析:因为没有480 mL的容量瓶,只能配制500 mL溶液;计算时注意,需8 g CuSO4或12.5 g CuSO4·5H2O。
答案:D
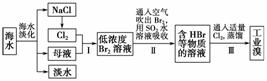
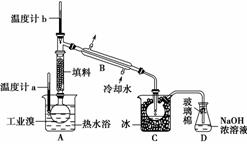 (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图;
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图;
 Fe(OH)3+3HCl,Mg与水解产生的盐酸反应生成H2,并使平衡向正反应方向移动,生成Fe(OH)3沉淀。
Fe(OH)3+3HCl,Mg与水解产生的盐酸反应生成H2,并使平衡向正反应方向移动,生成Fe(OH)3沉淀。