13.铁做为重要的金属元素与人类生产生活密切相关,某课外活动小组在学习了氧化剂和还原剂后,要利用实验验证铁及其化合物的性质。
请你帮助他们完成以下实验报告:
(1)实验目的:探究铁及其化合物的氧化性和还原性。
(2)试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
(3)仪器:胶头滴管,________(你认为本实验必不可少的一种玻璃仪器)。
(4)实验记录(划斜线部分不必填写)
|
序号 |
实验内容 |
实验现象 |
离子方程式 |
实验结论 |
|
① |
在FeCl2溶液中滴入适量氯水 |
溶液由浅绿色变为黄色 |
|
Fe2+具有还原性 |
|
② |
在FeCl2溶液中加入锌片 |
- |
Zn+Fe2+===Zn2++Fe |
|
|
③ |
在FeCl3溶液中加入足量铁粉 |
|
Fe+2Fe3+===3Fe2+ |
Fe3+具有氧化性 |
|
④ |
|
- |
- |
Fe3+具有氧化性 |
(5)实验结论:Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性。
①根据以上结论判断,下列物质中既有氧化性,又有还原性的有________(填序号)。
A.Cl2 B.Na C.Na+ D.Cl- E.SO2 F.NO2
②亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶
液时应该________防止亚铁盐被氧化。
解析:根据探究实验目的和提供的试剂分析,本实验只需要试管和胶头滴管就可以完
成。再结合实验记录中部分内容,就可以判断利用铁粉与FeCl3反应,探究出Fe的还
原性,Fe3+的氧化性;利用提供的氯水、FeCl2(aq),推断Fe2+具有还原性,利用FeCl2(aq)
和锌片推断Fe2+有氧化性。最后推出具有中间价态的Fe2+既具有氧化性又具有还原
性,从而判断A、E、F也符合以上规律。
答案:(3)试管 (4)①Cl2+2Fe2+===2Cl-+2Fe3+ ②Fe2+具有氧化性 ③铁粉逐渐溶
解,溶液由黄色变为浅绿色 ④在FeCl3溶液中加入铜片 (5)①AEF ②在亚铁盐溶
液中加入少量铁粉
11.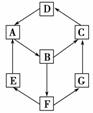 (原创)在一次化学兴趣小组活动中,一小组利用物质间互变,设计成一平面“魔方”,如图所示:
(原创)在一次化学兴趣小组活动中,一小组利用物质间互变,设计成一平面“魔方”,如图所示:
已知:①A、B、C、D、G含有同一种元素。
②有下列表格:
平面“魔方”
|
物质 |
纯A(单质) |
B(溶液) |
D(固体) |
G(溶液) |
|
颜色 |
银白色 |
黄色 |
红棕色 |
浅绿色 |
③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉
淀;在水溶液中B也能将一种气体氧化物氧化为F,F是含有三种元素的化合物,
与A反应生成E和G。
根据以上信息填空:
(1)写出D的化学式________;G生成C的过程中所出现的现象为___________
_____________________________________________________________。
(2)写出下列反应的化学方程式:E→A________;A→B________。
(3)B→F的离子方程式为__________________________________________。
解析:本题切入点是物质的颜色。依题意,E为氢气,B中含氯离子,所以B为氯
化铁,A为铁。D为氧化铁,F与铁反应生成氢气和G,F是一种气体氧化物在水
溶液中被氯化铁氧化而成,说明F为硫酸,G为硫酸亚铁,则C为Fe(OH)3。
答案:(1)Fe2O3 先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色 (2)4H2+
Fe3O43Fe+4H2O 2Fe+3Cl22FeCl3 (3)2Fe3++SO2+2H2O===2Fe2+
+SO+4H+
10.类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量
时,产物是Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,
当Cl2足量时生成FeCl3,当铁粉过量时产物是FeCl2。为验证该观点是否正确,该
同学将一根细的纯铁丝分别在足量和少量的Cl2中点燃,取其表面生成物并分别编
号为A、B,然后通过实验确定其成分。探究过程如下:
(1)提出假设:A是FeCl3,B是FeCl2。
(2)设计实验方案:分别取A、B的溶液进行以下实验,但实验现象相同。请填写下
表中的相应空格。
|
实验方法 |
实验现象 |
结 论 |
|
分别向A、B溶液中加KSCN溶液 |
|
固体物质中有FeCl3 |
|
分别向KMnO4溶液中加适量A、B溶液 |
KMnO4溶液颜色无明显变化 |
固体物质中不含________ |
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式:
________________________。
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显
错误的是_______________________________________________________。
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到FeCl3固体
解析:(2)由分别向A、B溶液中加入KSCN溶液后,得出的结论为固体物质中有三
氯化铁,可知实验现象为A、B溶液遇KSCN溶液均显红色;由分别向高锰酸钾溶
液中加入A、B,高锰酸钾有强氧化性,如果有Fe2+存在,能使KMnO4溶液褪色,
但实验现象是高锰酸钾溶液颜色无明显变化,所以该固体中不含有FeCl2。(3)由上述
实验结论可知,铁在氯气中燃烧,无论铁粉过量还是少量均得到三氯化铁。(4)向FeCl3
溶液中加入铁粉,将三价铁还原为二价铁,颜色变浅;加热FeCl3溶液时促进FeCl3
水解:FeCl3+3H2OFe(OH)3↓+3HCl,蒸干并灼烧,最后得到的固体是三氧化
二铁,所以答案为BD。
答案:(2)溶液均变红色 FeCl2 (3)2Fe+3Cl22FeCl3 (4)BD
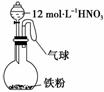 如右图所示,向一定量的铁粉中加入一定体积12
mol/L的硝酸,加热充分反应后,下列微粒在体系中一定大量存在的是( )
如右图所示,向一定量的铁粉中加入一定体积12
mol/L的硝酸,加热充分反应后,下列微粒在体系中一定大量存在的是( )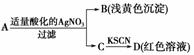 某同学设计下列方法对A盐的水解液进行鉴定:
某同学设计下列方法对A盐的水解液进行鉴定: