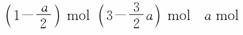2.取5支试管,编号分别为1,2,3,4,5,然后各取步骤(1)中FeCl3和KSCN的混合溶液4 Ml
加到5支试管中。往1号试管滴加2-3滴1.0 mol/L FeCl3溶液,振荡,观察现象;往2
号试管滴加2-3滴1.0 mol/L KSCN溶液,振荡,观察现象;往3号试管中加入少量KCl
固体,振荡,观察现象;往4号试管中滴加2-3滴1.0 mol/L NaF溶液,振荡,观察
现象。
根据你所学的内容完成下列表格,并回答有关问题。
FeCl3与KSCN溶液反应
|
编号 |
混合溶液颜色 |
滴加的溶液 |
溶液颜色的变化 |
平衡移动的方向 |
|
1 |
橙红色 |
FeCl3 |
①颜色______了,由橙红色变成了______色 |
③向______移动 |
|
2 |
橙红色 |
KSCN |
②颜色______了,由橙红色变成了______色 |
④向______移动 |
|
3 |
橙红色 |
KCl |
颜色变浅了,由橙红色变成了黄色 |
⑤向______移动 |
|
4 |
橙红色 |
NaF |
颜色变浅了,由橙红色变成了无色 |
⑥向______移动 |
|
5 |
橙红色 |
- |
橙红色 |
不移动 |
(1)由①②现象说明假设______成立,假设______不成立。
 (2)根据Fe3++3SCN- Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象
(2)根据Fe3++3SCN- Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象
却是变浅了,请你分析变浅的可能原因是
________________________________________________________________________。
(3)根据“4”号试管中的现象,分析在4号试管中发生的变化是____________,说明了
__________(从改变浓度影响平衡移动角度回答)
 解析:FeCl3与KSCN发生的化学反应为:FeCl3+3KSCN Fe(SCN)3+3KCl,Fe3
解析:FeCl3与KSCN发生的化学反应为:FeCl3+3KSCN Fe(SCN)3+3KCl,Fe3
 +3SCN- Fe(SCN)3。加入FeCl3或KSCN(增大反应物浓度)会使平衡向右移动,
+3SCN- Fe(SCN)3。加入FeCl3或KSCN(增大反应物浓度)会使平衡向右移动,
颜色加深,加入KCl固体,颜色变浅,说明平衡向左移动,可能是加入的Cl-与Fe3+形
成配位离子,减小了Fe3+的浓度。加入NaF溶液变为无色,说明F-与Fe3+形成了比
Fe(SCN)3更稳定的配位化合物,使平衡向左移动。
答案:①加深 血红 ②加深 血红 ③右 ④右 ⑤左 ⑥左 (1)1 2 (2)Fe3+与Cl
-形成络离子,使Fe3+浓度减小,平衡向左移动 (3)F-与Fe3+形成了无色的且比Fe(SCN)3
稳定的化合物(络合物) 减小反应物的浓度会使平衡向逆反应方向移动。
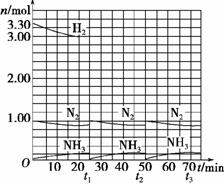
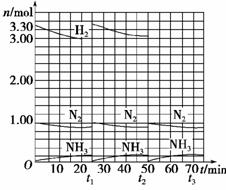
 P(g)+Q(g);ΔH>0,请回答下列问题:
P(g)+Q(g);ΔH>0,请回答下列问题: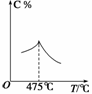 答案:(1)25% (2)增大 (3)6 (4)41%
答案:(1)25% (2)增大 (3)6 (4)41%