18.某化学兴趣小组的成员捡到一块矿石,观察外观发现该矿石坚硬且呈红褐色,投入水中
没有任何变化,再向水中加浓盐酸至过量,矿石部分溶解,并有大量无色气体生成。学
生猜测该矿石可能由CaCO3、SiO2、Fe2O3三种成分组成,试设计实验证明CaCO3以外
的两种成分。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、滴管、药匙、漏斗、漏斗架;2 mol/L盐
酸、2 mol/L NaOH溶液、2% KSCN溶液。
(1)将实验方案用以下流程示意图表示,试写出每步所用试剂名称或化学式。
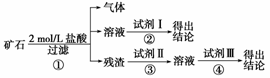
试剂Ⅰ__________;试剂Ⅱ__________;试剂Ⅲ__________。
(2)如果猜测是成立的,试根据上述实验方案,叙述实验操作,预期现象和结论。
|
编号 |
实验操作 |
预期现象与结论 |
|
① |
取适量矿石研细,加足量2
mol/L盐酸 |
大量无色气体生成,得棕黄色溶液,且仍有少量固体残留 |
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
解析:Fe2O3可溶于盐酸,在溶液中存在Fe3+,可用SCN-检验其存在,从而说明矿石
中含Fe2O3;SiO2不溶于盐酸,作为残渣被滤出。为进一步确认,加入NaOH溶液,
充分反应后,再加盐酸,如果生成白色胶状沉淀则说明矿石中有SiO2。
答案:(1)2% KSCN溶液 2 mol/L NaOH溶液 2 mol/L盐酸
(2)
|
② |
取①操作得到的溶液少许置于洁净试管,并滴加几滴2%
KSCN溶液 |
溶液变为红色,说明原矿石中可能含有Fe2O3 |
|
③ |
取①操作得到的残余固体适量置于烧杯,加入足量2
mol/L NaOH溶液,充分搅拌 |
残余固体完全溶解于2
mol/L NaOH溶液,并得无色溶液 |
|
④ |
取③操作得到的无色溶液少许置于洁净试管,用胶头滴管滴入2
mol/L盐酸至过量 |
有白色胶状沉淀且不溶于过量的盐酸,说明原矿石中可能含有SiO2 |
 ,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必定降低,即另一种物质是H2。
,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必定降低,即另一种物质是H2。