16.在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后`溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是__________(填粒子
的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物质是
________。
(2)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及
实验中观察到的现象。
|
____同学正确 |
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是
______________。若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为
是否可行?________,理由是___________________________________________
________________________________________________________________________。
解析:溴能够溶解于有机溶剂中,而Fe3+可以用KSCN溶液检验。
答案:(1)Br2 Fe3+
(2)如下表:
|
乙同学正确 |
选用试剂 |
实验现象 |
|
第一种方法 |
C |
有机层无色 |
|
第二种方法 |
D |
溶液变红色 |
(3)Fe2+ 不可以 因为Br2和Fe3+都能把I-氧化成I2
 2C(g);ΔH<0,达到平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
2C(g);ΔH<0,达到平衡后,将气体混合物的温度降低,下列叙述中正确的是( )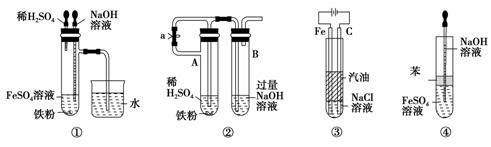
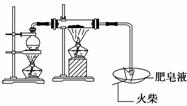
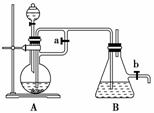 答案:(1)肥皂泡破裂,有爆鸣声 3Fe+4H2O(g)Fe3O4+4H2 (2)①B ②B ③6.6 V×100%
答案:(1)肥皂泡破裂,有爆鸣声 3Fe+4H2O(g)Fe3O4+4H2 (2)①B ②B ③6.6 V×100%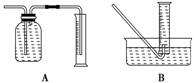
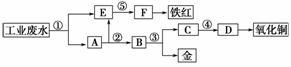
 (3)Fe2O3 用作红色颜料 用作制造铜盐的原料
(3)Fe2O3 用作红色颜料 用作制造铜盐的原料