20.(10分)有一化学兴趣小组进行了下列实验:将铁粉与铜粉的均匀混合物平均分成五等份,分别加入同浓度的稀硝酸,充分反应。记录生成NO的体积(已折算成标准状况下的体积)和剩余金属的质量如下表(设硝酸的还原产物只有NO):
|
编号 |
① |
② |
③ |
④ |
⑤ |
|
稀硝酸体积/mL |
100 |
200 |
300 |
400 |
500 |
|
剩余金属/g |
18.0 |
9.6 |
0 |
0 |
0 |
|
NO体积/mL |
2240 |
4480 |
6720 |
8960 |
8960 |
请回答:(1)编号①反应过程中转移的电子总数为 mol。
(2)编号④反应后溶液中所含金属离子为 (填化学式)。
(3)该稀硝酸的物质的量浓度(写出计算过程)。
(4)混合物中铁与铜的物质的量之比为 。
18.(10分)下表是某食用碘盐包装袋上的部分说明:
|
配 料 |
食盐、碘酸钾、抗结剂 |
|
碘含量 |
35±15mg/kg |
|
储藏方法 |
密封、避光、防潮 |
|
食用方法 |
烹饪时,待食品熟后加入碘盐 |
(1)下列说法正确的是
A.高温会导致碘的损失 B.碘酸钾可氧化氯化钠
C.只用淀粉就能检验碘盐中的碘酸钾 D.该碘盐中碘酸钾含量为20~50mg/kg
|
(3)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,并标出电子转移的方向和数目。
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
该反应的氧化剂为
(4)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用碘盐中碘的含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解 b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全 c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示) mg/kg。
15.(10分)化学是一门以实验为基础的自然科学,化学实验在化学学习
中具有重要的作用。
(1) 右图分别是温度计、量筒、滴定管的一部分,其中
A仪器的名称为 , B的正确读数为 。
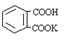 (2)实验室很难配制准确浓度的NaOH溶液,需要用基准物质来标定,邻苯二甲酸氢钾( ,,相对分子质量为204.0)是常用的基准物质。某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度。在本实验中达到滴定终点时,溶液的pH约为9.1。
(2)实验室很难配制准确浓度的NaOH溶液,需要用基准物质来标定,邻苯二甲酸氢钾( ,,相对分子质量为204.0)是常用的基准物质。某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度。在本实验中达到滴定终点时,溶液的pH约为9.1。
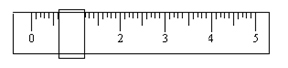 ①该学生用托盘天平称量时,先在两边托盘上放等质量的纸片,取少量邻苯二甲酸氢钾置于左盘,只用游码(单位:g)调整平衡时如下图所示。由此可知,所取邻苯二甲酸氢钾的质量为 g。
①该学生用托盘天平称量时,先在两边托盘上放等质量的纸片,取少量邻苯二甲酸氢钾置于左盘,只用游码(单位:g)调整平衡时如下图所示。由此可知,所取邻苯二甲酸氢钾的质量为 g。
②将称好的邻苯二甲酸氢钾置于锥形瓶中,加适量蒸馏水完全溶解得到无色溶液,再加入1~2滴
指示剂,当观察到 现象时,可停止滴定,记录数据。
|
实验编号 |
NaOH溶液的体积(mL) |
|
1 |
22.52 |
|
2 |
22.49 |
|
3 |
22.50 |
③该学生进行了三次实验,所取固体质量均相同,达到滴定终点时记录所用未知氢氧化钠溶液的体积如下表:
则计算氢氧化钠溶液物质的量浓度的表达式为: (用数据表示,不需计算)
④以下操作会造成NaOH溶液浓度偏高的是 (填序号)
A.未用氢氧化钠溶液洗涤碱式滴定管
B.滴定前平视,滴定后俯视读数
C.滴定前滴定管尖嘴有气泡,滴定后气泡消失
D.滴定前未用邻苯二甲酸氢钾溶液洗锥形瓶
 正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同)。A、B的晶体类型相同。单质A的同素异形体能与B物质发生置换反应。C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同。C、E、F的晶体类型相同,由E构成的物质常温下呈液态。
正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同)。A、B的晶体类型相同。单质A的同素异形体能与B物质发生置换反应。C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同。C、E、F的晶体类型相同,由E构成的物质常温下呈液态。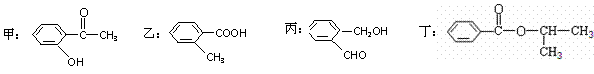 (12分)根据下列有机化合物,回答问题。
(12分)根据下列有机化合物,回答问题。
 CH3OH(g);ΔH <
0
CH3OH(g);ΔH <
0


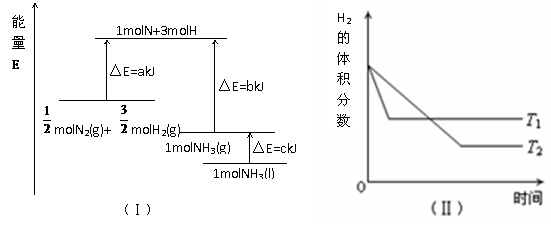
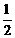 N2(g)+
N2(g)+  H2(g)=NH3(g);△H = (a+b)kJ·mol-1
H2(g)=NH3(g);△H = (a+b)kJ·mol-1 D. 其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大
D. 其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大