3.根据下列实验内容得出的结论正确的是:
|
选项 |
实验内容 |
结论 |
|
A |
某物质的水溶液使红色石蕊试纸变蓝 |
该物质一定是碱 |
|
B |
某气体能使湿润淀粉碘化钾试纸变蓝 |
该气体一定是氯气 |
|
C |
某物质的水溶液中加入盐酸产生无色无味气体 |
该溶液一定含有碳酸根离子 |
|
D |
0.84g铁和50.00mL 1.00mol/L的稀硝酸反应 |
反应后溶液中一定有Fe3+和Fe2+ |
10.(16分)向草酸(H2C2O4)溶液中逐滴加入酸性高锰酸钾溶液反应时,溶液褪色总是先慢后快。为了探究此反应速率由小变大的原因,设计如下实验
已知:①MnO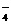 在酸性环境下的还原产物是Mn2+;
在酸性环境下的还原产物是Mn2+;
②草酸是二元弱酸,有毒,温度较高时分解。
(1)0.10mol/L H2C2O4溶液的配制:K^S*5U.C#O
实验室欲配制100mL 0.10mol/L H2C2O4 溶液,需要用托盘天平称取草酸晶体(H2C2O4·2H2O) g;实验中需要用到的玻璃仪器除了玻璃棒、胶头滴管外还有: 。(填代号)
(2)反应速率变化的探究
取4支试管,按以下四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化均如下:紫红色→红色→橙红色→橙色→黄色→无色,但溶液褪为无色所需的时间不同,如下表所示:(表中“-”表示未加入该试剂)
|
实验 编号 |
温度(利用水浴加热) |
0.10mol/L 草酸溶液 |
稀硫酸 溶液 |
MnSO4固体 |
0.10 mol/L KMnO4溶液 |
褪色 时间 |
|
1 |
65℃ |
5mL |
- |
- |
1mL |
100s |
|
2 |
65℃ |
5mL |
10滴 |
- |
1mL |
90s |
|
3 |
75℃ |
5mL |
10滴 |
- |
1mL |
40s |
|
4 |
75℃ |
5mL |
10滴 |
加入少许 |
1mL |
3s |
①H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为 ;
②设计对比实验1、2的目的是:_____________________________________________ ;
③由表中数据可以得出,温度对该化学反应速率的影响是:________________________;
为了加快该反应的反应速率,是不是水浴的温度越高越好?_______(填“是”或“否”);
④由以上4个实验,还可以得出的一个结论是:_____________________________
⑤若为了探究浓度对该反应速率的影响,则在所设计的实验中最好是增大________(填“草酸”或“高锰酸钾”)溶液的浓度,以减少实验误差。

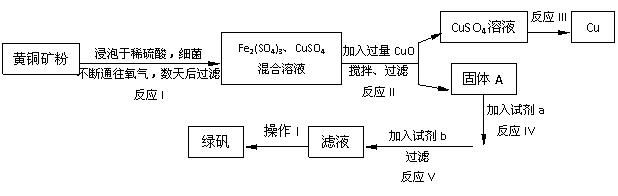 某工厂运用该原理生产铜和绿矾(FeSO4·7H2O)的工艺如下:
某工厂运用该原理生产铜和绿矾(FeSO4·7H2O)的工艺如下: