2. 下列有关化学用语或名称表达正确的是
下列有关化学用语或名称表达正确的是
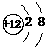 A.Mg的原子结构示意图: B.乙酸分子的比例模型:
A.Mg的原子结构示意图: B.乙酸分子的比例模型:
|
|
16.(探究创新题)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、Al3+、Ag+、Ba2+ |
|
阴离子 |
OH-、Cl-、CO32-、NO3-、SO42- |
请根据以下实验事实逐步推出它们的名称并回答问题:
(1)
|
物质鉴定实验 |
推导结论 |
|
①用pH试纸测出A、B溶液呈碱性,C、D、E溶液呈酸性 |
A、B中含有的阴离子为________,C、D、E中含有的阳离子为______________ |
|
②A溶液与E溶液反应既有气体又有沉淀产生;A与C反应只有气体产生 |
A为________, C含________离子 |
|
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀 |
D为________ |
(2)写出E溶液与过量的B溶液反应的离子方程式:
_______________________________________________________。
(3)在100 mL 0.1 mol/L的E溶液中,逐滴加入35 mL 2 mol/L NaOH 溶液,最终得到沉淀的物质的量为________________。
14.某研究性学习小组,拟通过实验除去NaCl晶体中混有的少量Na2SO4和NH4HCO3杂质,得到纯净的NaCl晶体。
(1)请填写表中空格,完成由上述混合物得到纯净的NaCl晶体的实验设计。
|
|
实验步骤 |
实验目的 |
证明达到实验目的的操作和现象 |
|
① |
加热 |
除去NH4HCO3 |
加热、冷却、称量至固体质量恒定且减轻 |
|
② |
将①所得固体溶于水,加入BaCl2溶液,过滤 |
|
|
|
③ |
|
除去Ba2+ |
|
|
④ |
向③的滤液中加入过量稀盐酸,加热近沸 |
|
________ |
|
⑤ |
|
获得NaCl晶体 |
________ |
(2)写出实验中有关反应的离子方程式_____________________________________________________。
10.下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是 ( )
|
编号 |
化学反应 |
离子方程式 |
评价 |
|
A |
碳酸钙与醋酸反应 |
CO32-+2CH3COOH===2CH3COO-+H2O+CO2↑ |
错误,碳酸钙是弱电解质,不应写成离子形式 |
|
B |
氢氧化钠溶液中通入过量CO2 |
OH-+CO2=== HCO3- |
错误,通入过量CO2应生成CO32- |
|
C |
碳酸氢钠的水解 |
HCO3-+H2O H2CO3+OH- H2CO3+OH- |
正确 |
|
D |
等物质的量的FeBr2和Cl2反应 |
2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl- |
正确 |