7.根据实验室中测定硫酸铜晶体结晶水含量的实验,填写下列空白。
(1)从下列仪器选出所需仪器(用标号字母填写)__________。
A.托盘天平(带砝码) B.研钵 C.试管夹 D.酒精灯 E.蒸发皿 F.玻璃棒 G.坩埚 H.干燥器 I.石棉网 J.三脚架?
除上述仪器外,还需要的仪器是__________。
(2)某学生实验后得到以下数据:
|
加热前质量 |
加热后质量 |
|
|
W1(容器) |
W2(容器+晶体) |
W3(容器+无水硫酸铜) |
|
5.4 g |
7.9 g |
6.8 g |
请写出结晶水含量(x%)的计算公式(用W1、W2、W3表示)
x%=__________,该生测定结果是偏高还是偏低?__________。
从下列分析中选出该学生产生实验误差的原因可能是(填写字母)__________。
A.加热前称量时容器未完全干燥
B.最后两次加热后的质量相差较大(大于0.1 g)
C.加热后容器未放入干燥器中冷却
D.加热过程中晶体有少量溅失
解析:本题考查硫酸铜晶体中结晶水含量测定实验中仪器选择、数据处理、误差分析等基本内容。解题时要回忆整个实验过程才能准确无误地选择仪器或列出缺少的仪器。误差分析时注意根据计算公式进行判断。
答案:(1)A、B、D、F、G、H、J 坩埚钳、泥三角、药匙
(2)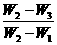 ×100% 偏高 AD
×100% 偏高 AD
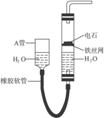
4.拟用图15-8装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去,必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
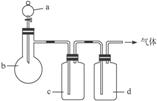
图15-8
|
气体 |
a |
b |
c |
D |
|
C2H4 |
乙醇 |
浓H2SO4 |
NaOH溶液 |
浓H2SO4 |
|
Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓H2SO4 |
|
NH3 |
饱和NH4Cl溶液 |
消石灰 |
H2O |
固体NaOH |
|
NO |
稀HNO3 |
铜屑 |
H2O |
P2O5 |
(1)上述方法中可以得到干燥、纯净的气体是___________。
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)。
①气体___________,理由是__________________________________________。
②气体___________,理由是__________________________________________。
③气体___________,理由是__________________________________________。
④气体___________,理由是__________________________________________。
解析:制备C2H4需控制温度在170 ℃,装置中无温度计,则无法控制温度;加热浓盐酸与MnO2可以产生Cl2,但Cl2与NaOH反应,被装置c吸收;饱和NH4Cl溶液与消石灰反应产生的NH3会被c中的水吸收。只有Cu与稀HNO3反应产生的NO可以制得;通过c的目的是除去NO与装置中的空气接触而生成的NO2气体,用P2O5干燥后可得干燥、纯净的NO气体。
答案:(1)NO
(2)①C2H4 装置中没有温度计,无法控制反应温度 ②Cl2 反应生成的Cl2被c中的NaOH溶液吸收了
③NH3 反应生成的NH3被c中的H2O吸收了?
 2CuO;CuO+H2SO4====CuSO4+H2O。对比甲的方案,乙同学方案的优点是:
2CuO;CuO+H2SO4====CuSO4+H2O。对比甲的方案,乙同学方案的优点是: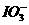 +5I-+6H+====3I2+3H2O。
+5I-+6H+====3I2+3H2O。
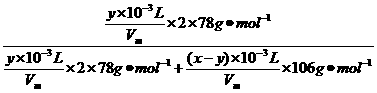 。
。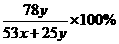
 Ca(OH)2+C2H2↑
Ca(OH)2+C2H2↑
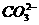 ====CaCO3↓, CaCO3+2H+====Ca2++CO2↑+H2O
====CaCO3↓, CaCO3+2H+====Ca2++CO2↑+H2O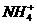
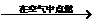 在空气中点燃CO
在空气中点燃CO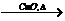 CO2
CO2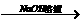 Na2CO3
Na2CO3 Cu(NO3)2溶液
Cu(NO3)2溶液 Fe2O3
Fe2O3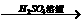 Fe2(SO4)3溶液
Fe2(SO4)3溶液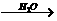 Ca(OH)2溶液
Ca(OH)2溶液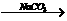 NaOH溶液
NaOH溶液