28、某钙片的标签如右图所示,已知此钙片成分中只有碳酸钙含有钙元素。
(1) 请通过计算说明此标签中的含钙量是否错误。(2分)
(2)为测定其真实的含钙量,小东每次取10片钙片放入已称量的含足量盐酸的烧杯中,发生的化学反应是;CaCO3+2HCl=CaCl+H2O+CO2↑,充分反应后再称取烧杯和剩余物的总质量。小东做了三次实验,数据如下:
|
物质的质量 |
第一次 |
第二次 |
第三次 |
平均值 |
|
反应前:烧杯+盐酸 |
22 g |
22 g |
22 g |
22 g |
|
10片钙片 |
8 g |
8 g |
8 g |
8 g |
|
反应后:烧杯十剩余物 |
26.7 g |
26.5 g |
26.9 g |
26.7g |
① 请列式计算每片此钙片含碳酸钙的质量。(3分)
②请列式计算每片此钙片的含钙量,并建议厂家如何改标签。(2分)
|
执行标准:GB1413-99 主要成分:碳酸钙 含钙量:每片含钙0.75g 每瓶50片,重 40 g (中外合资xx公司出品) |
(二)实验探究:针对上面的猜想①至猜想⑤,化学活动小组依次设计了实验方案,进行了实验验证,并依次观察到下列实验现象。请你将他们设计的可行的实验探究方案,填写在下表中。
|
猜想 |
可行的实验方案 |
实验现象 |
|
猜想① |
将一小块果肉浸入盛有蒸馏水的烧杯中,观察现象。 |
果肉表面不变色。 |
|
猜想② |
将一小块切开的苹果放入盛有氮气的集气瓶中,观察现象。 |
果肉表面不变色。 |
|
猜想③ |
将切开的苹果放入盛有____________的集气瓶中,观察现象。 |
果肉表面变色。 |
|
猜想④ |
|
果肉表面不变色。 |
|
猜想⑤ |
|
温度高的先变色。 |
[得出结论]影响切开的苹果“生锈”的因素是 。
[反思与评价]
(1)在②~⑤四种猜想中,认为猜想②最不合理,理由是 。
(2)在验证猜想①时,同学们发现,如果水不与空气隔绝,果肉放在水中时间长了也会变色,其可能的原因是 。
[应用]
根据上述结论,要防止果汁变质,果品加工厂加工和保存果汁时可采取的措施是 。
26、(7分)“用双氧水和二氧化锰制氧气”实验后,展开了下列思考与探究:
(1)催化剂MnO2的用量对反应速率有没有影响呢?他做了这样一组实验:每次均用30mL10%的H2O2溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
|
实 验 次 序 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
MnO2粉末用量(克) |
0.1 |
0.2 |
0.3 |
0.4 |
0.5 |
0.6 |
0.7 |
0.8 |
0.9 |
1.0 |
|
所用时间(秒) |
17 |
8 |
7 |
5 |
4 |
3 |
2 |
2 |
2 |
2 |
请分析表中数据回答:MnO2的用量对反应速率有没有影响呢?如果有,是怎样影响的呢?答: 。(2分)
(2)H2O2溶液的溶质质量分数对反应速率有没有影响呢?他又做了一组实验:每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验。记录数据如下:(实验均在20℃室温下进行,其他实验条件也均相同)
|
实 验 次 序 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
H2O2溶液溶质质量分数 |
1% |
3% |
5% |
10% |
15% |
20% |
25% |
30% |
|
MnO2粉末用量(克) |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
0.2 |
|
收集到540mL气体时所用时间(秒) |
660 |
220 |
205 |
80 |
25 |
9 |
4 |
3 |
|
反应后液体温度(℃) |
24 |
34 |
39 |
56 |
65 |
67 |
69 |
70 |
请分析表中数据回答:H2O2溶液的溶质质量分数对反应速率有没有影响呢?如果有,是怎样影响的呢?答: 。(2分)
由表中数据还可看出,该反应是个 反应(填“放热”或“吸热”)。(1分)
(3)还有哪些因素可能影响该反应的速率呢?请说出你的一个猜想:
。(2分)
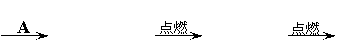 (6分)甲、乙均是一种液体,A、B、C均为黑色固体,D通入加水紫色石蕊试液中,试液变红色。E是一种气体单质,F是生活中常见的银白色金属,它们之间有下列转化关系:
(6分)甲、乙均是一种液体,A、B、C均为黑色固体,D通入加水紫色石蕊试液中,试液变红色。E是一种气体单质,F是生活中常见的银白色金属,它们之间有下列转化关系: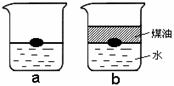 22(4分)钠是一种非常活泼的金属,用小刀切一小块钠投入到盛有蒸馏水的烧杯中(图a),可以看到钠块浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔化成银白色的小球,甚至使生成的气体发生燃烧。如果在盛蒸馏水的烧杯中先注入一些煤油再投入金属钠,可以看到金属钠悬浮在煤油和水的界面上(如图b),同样与水发生剧烈反应,生成氢氧化钠和另一种单质气体,但不发生燃烧。试根据以上叙述,解答下列问题:
22(4分)钠是一种非常活泼的金属,用小刀切一小块钠投入到盛有蒸馏水的烧杯中(图a),可以看到钠块浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔化成银白色的小球,甚至使生成的气体发生燃烧。如果在盛蒸馏水的烧杯中先注入一些煤油再投入金属钠,可以看到金属钠悬浮在煤油和水的界面上(如图b),同样与水发生剧烈反应,生成氢氧化钠和另一种单质气体,但不发生燃烧。试根据以上叙述,解答下列问题: