摘要:20.草酸亚铁用作分析试剂及显影剂等.其制备流程如下: (1)配制(NH4)2Fe(SO4)2·6H2O溶液时.需加少量稀硫酸.目的是 ▲ . (2)将制得的产品在氩气气氛中进行热重分析.结果如右图(TG%表示残留固体质量占原样品总质量的百分数). ①则A→B发生反应的化学方程式为: ▲ . C处时残留物的化学式为 ▲ . ②有研究学者在实验过程中用气相色谱还检出H2.最终产物中也有微量的磁性物质生成.请你猜想用一个方程式解释这种事实: ▲ . ③现取在真空中146℃脱水后的FeC2O4 1.44g放在某真空的密闭容器中.再充入0.04molCO.加热至1100℃.其中FeO Fe(s)+CO2(g)反应平衡常数K=0.4.则该反应达平衡时.FeO的转化率为多少? ▲
网址:http://m.1010jiajiao.com/timu3_id_433949[举报]
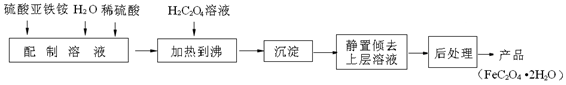
草酸亚铁用作分析试剂及显影剂等,其制备流程如图甲:
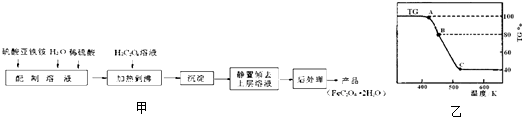
(1)配制(NH4)2Fe(SO4)2?6H2O溶液时,需加少量稀硫酸,目的是
(2)将制得的产品在氩气气氛中进行热重分析,结果如图乙(TG%表示残留固体质量占原样品总质量的百分数,Fe(SO4)2?2H2O的式量为180).
①A→B发生反应的化学方程式为
②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO.加热至1100℃,其中FeO(s)+CO(g)?Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?
查看习题详情和答案>>

(1)配制(NH4)2Fe(SO4)2?6H2O溶液时,需加少量稀硫酸,目的是
抑制Fe2+水解
抑制Fe2+水解
.(2)将制得的产品在氩气气氛中进行热重分析,结果如图乙(TG%表示残留固体质量占原样品总质量的百分数,Fe(SO4)2?2H2O的式量为180).
①A→B发生反应的化学方程式为
FeC2O4.2H2O(s)
FeC2O4(s)+2H2O(g)
| ||
FeC2O4.2H2O(s)
FeC2O4(s)+2H2O(g)
.C处时残留物的化学式为
| ||
FeO
FeO
.②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:
3FeO+H2O
Fe3O4+H2
| ||
3FeO+H2O
Fe3O4+H2
.
| ||
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO.加热至1100℃,其中FeO(s)+CO(g)?Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?
71.4%
71.4%
.(11分)草酸亚铁用作分析试剂及显影剂等,其制备流程如下:
(1)配制(NH4)2Fe(SO4)2 6H2O溶液时,需加少量稀硫酸,目的是________________________________________________________。
6H2O溶液时,需加少量稀硫酸,目的是________________________________________________________。
(2)将制得的产品在氩气气氛中进行热重分析,结果如图10(TG%表示残留固体质量占原样品总质量的百分数)。
①A B发生反应的化学方程式为
B发生反应的化学方程式为
__________________________________________。
C处时残留物的化学式为______________。
②有研究学者在实验过程中用气相色谱还检出
H2,最终产物中也有微量的磁性物质生成,_____________________________
请你猜想用一个方程式解释这种事实:______________________________ 。
③ 现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g) Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?____________________________。
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?____________________________。
草酸亚铁用作分析试剂及显影剂等,其制备流程如下:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加少量稀硫酸,目的是_________________。
(2)将制得的产品在氩气气氛中进行热重分析,结果如图10(TG%表示残留固体质量占原样品总质量的百分数)。
(2)将制得的产品在氩气气氛中进行热重分析,结果如图10(TG%表示残留固体质量占原样品总质量的百分数)。

图10
①A B发生反应的化学方程式为______________。 C处时残留物的化学式为_________。
②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:___________________________________。
③ 现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g) Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?__________________。
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?__________________。
查看习题详情和答案>>
②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:___________________________________。
③ 现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g)
 Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?__________________。
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?__________________。 草酸亚铁用作分析试剂及显影剂等,其制备流程如下
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加少量稀硫酸,目的是_________________。
(2)将制得的产品在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。
(2)将制得的产品在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。
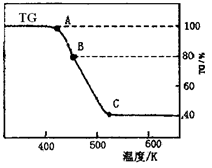
①则C处时残留物的化学式为______________。
②有研究学者在实验过程中用气相色谱还检出H2,最终产 物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:___________________。
③现取在真空中146℃脱水后的FeC2O4 1.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g) Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?_________________。
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?_________________。
(3)金属镁在国民生产中有重要作用,常以MgCl2为原料获取,温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。结合下图请回答下列问题:
②有研究学者在实验过程中用气相色谱还检出H2,最终产 物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:___________________。
③现取在真空中146℃脱水后的FeC2O4 1.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g)
 Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?_________________。
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?_________________。(3)金属镁在国民生产中有重要作用,常以MgCl2为原料获取,温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。结合下图请回答下列问题:
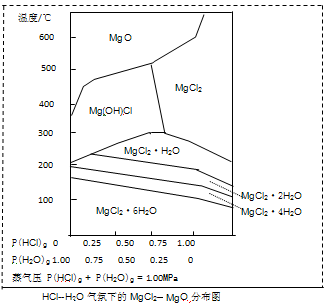
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式_______________________;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是________________;若要得到无水MgCl2须采取的措施是__________________。
查看习题详情和答案>>
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是________________;若要得到无水MgCl2须采取的措施是__________________。
草酸亚铁用作分析试剂及显影剂等,其制备流程如下
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加少量稀硫酸,目的是______________ 。
(2)将制得的产品在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。
(2)将制得的产品在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。
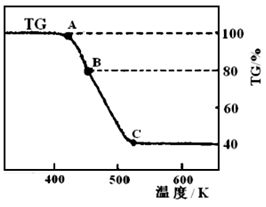
① A→B发生反应的化学方程式为_______________。 C处时残留物的化学式为__________。
②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:______________ 。
③ 现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g)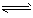 Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?________________
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?________________
查看习题详情和答案>>
②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:______________ 。
③ 现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO。加热至1100℃,其中FeO(s)+CO(g)
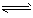 Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?________________
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?________________