23.(16分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
217 |
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据表回答下列问题:
(1)碲的化合价可能有_________________
(2)氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_______________________________________
(3)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
____A12Te3+_____( ) 一____A1(OH)3↓+____H2Te↑
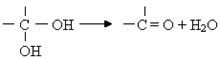
 (4)已知在常温下,H2和S反应生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式:_______________________
__________。
(4)已知在常温下,H2和S反应生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式:_______________________
__________。
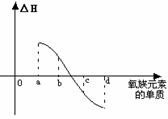
(5)右图所示为上述表格中氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△H为相同物质的量的单质与H2反应的反应热。则:b代表________________,d代表_____________(均写单质名称)。
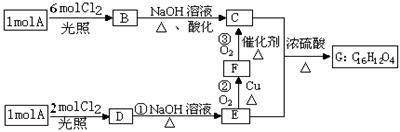
 其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。 TiCl4(l) + O2 (g) K^S*5U.C#O
TiCl4(l) + O2 (g) K^S*5U.C#O