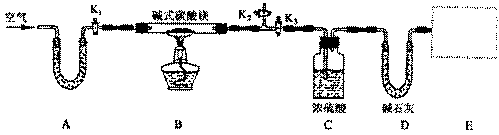
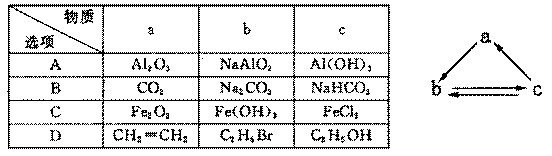
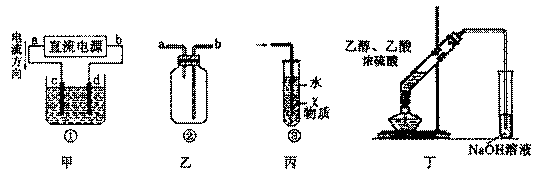
0 41881 41889 41895 41899 41905 41907 41911 41917 41919 41925 41931 41935 41937 41941 41947 41949 41955 41959 41961 41965 41967 41971 41973 41975 41976 41977 41979 41980 41981 41983 41985 41989 41991 41995 41997 42001 42007 42009 42015 42019 42021 42025 42031 42037 42039 42045 42049 42051 42057 42061 42067 42075 447348
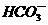 )为电解质,以具有催化作用和导电性能的高*考#资^源*网稀土金属为电极。
)为电解质,以具有催化作用和导电性能的高*考#资^源*网稀土金属为电极。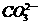 =5CO2+2H2O,则其正极电极反应式为____________;为使电解质的高*考#资^源*网组成保持稳定,使该燃料电池长时间稳定运行,在通入的高*考#资^源*网空气中必须加入________________物质。
=5CO2+2H2O,则其正极电极反应式为____________;为使电解质的高*考#资^源*网组成保持稳定,使该燃料电池长时间稳定运行,在通入的高*考#资^源*网空气中必须加入________________物质。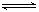 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据: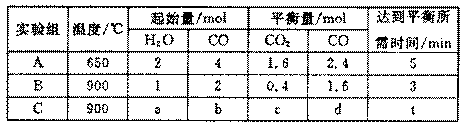
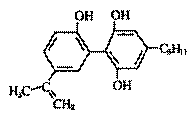 2008年我国举办奥运会的高*考#资^源*网理念是“绿色奥运”、“人文奥运”和“科技奥运”。坚决反对运动员服用兴奋剂是我国支持“人文奥运”的高*考#资^源*网一个重要体现。某种兴奋剂的高*考#资^源*网结构简式如右图所示,有关该物质的高*考#资^源*网说法错误的高*考#资^源*网是
2008年我国举办奥运会的高*考#资^源*网理念是“绿色奥运”、“人文奥运”和“科技奥运”。坚决反对运动员服用兴奋剂是我国支持“人文奥运”的高*考#资^源*网一个重要体现。某种兴奋剂的高*考#资^源*网结构简式如右图所示,有关该物质的高*考#资^源*网说法错误的高*考#资^源*网是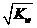 的高*考#资^源*网溶液:K+、Al3+、Cl-、
的高*考#资^源*网溶液:K+、Al3+、Cl-、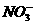 。
。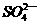 、K+、
、K+、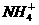 、Cl-、Na+、
、Cl-、Na+、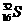 与
与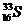 的高*考#资^源*网质子数相等,属于同一种元素的高*考#资^源*网不同核素
的高*考#资^源*网质子数相等,属于同一种元素的高*考#资^源*网不同核素