32.(16分)(1)工业上以粗铜为原料采取如图-1所示流程制备硝酸铜晶体:

①在步骤a中,还需要通入氧气和水,其目的是 。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
不用加水的方法调节溶液pH的原因是 。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)
。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是 。
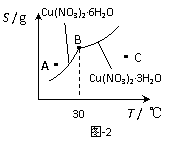 (3)图-2是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O
]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是
(填字母)。
(3)图-2是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O
]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是
(填字母)。
a. A点时的溶液为不饱和溶液
b. B点时两种晶体可以共存
c. 按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d. 若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体
(1)下列可产生二氧化硫污染大气的是 。(填序号)。
A.含硫矿石的冶炼 B.大量化石燃料的燃烧
 C.大量烟花爆竹的燃放 D.硫酸厂排放的工业尾气
C.大量烟花爆竹的燃放 D.硫酸厂排放的工业尾气
(2)某课外小组采集了一份雨水样品,每隔一段时间测定该雨水样品的pH变化数据如下
|
测试时间段 |
0 |
1 |
2 |
3 |
4 |
|
雨水的pH |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
分析雨水样品PH变化的原因(用文字和化学方程式说明)
。
(3)某实验小组欲探究二氧化硫的化学性质,设计如下实验,请完成实验报告。
|
序号 |
二氧化硫的性质 |
主要操作和现象 |
化学方程式 |
|
① |
|
将二氧化硫通入装有品红溶液的试管中,品红由红色变为无色 |
 |
|
② |
氧化性 |
|
|
|
③ |
|
将二氧化硫通入装有新制氯水的试管中,氯水由浅黄绿色变为无色 |
|
(4)目前通常采用滴定法测定食品中残留二氧化硫的含量。具体实验方法主要是:样品经处理后,加入氢氧化钾使残留的二氧化硫以亚硫酸盐的形式固定,再加入硫酸使二氧化硫游离,用碘标准溶液滴定二氧化硫。在滴定时用 (填名称)作指示剂,滴定终点的现象是 。
31.(16分)(1)①请写出乙烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式: 。
②已知:C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+ O2(g)=== CO2(g); △H=-394kJ·mol-1;
2CO(g)+ O2(g)=== 2CO2(g); △H=-566kJ·mol-1;
2H2(g)+ O2(g)=== 2H2O(g); △H=-484 kJ·mol-1;
试写出由C与水蒸气在高温条件下反应生成氢气和一氧化碳的热化学方程式 。
③可利用上述反应的相关物质设计一个燃料电池。如用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入乙烷和氧气。写出负极的电极反应式 。 (2)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合后溶液的pH=8的原因(用离子方程式表示): 。
②混合溶液中水电离出的c(H+)与0.1mol·L-1NaOH溶液中水电离出的c(H+)比较
(填<、>、=)。
 ③已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为 。(填序号)
③已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为 。(填序号)
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
 C
C
 a.Na
b.Na2CO3 c.Br2/CCl4 d.CH3COOH
a.Na
b.Na2CO3 c.Br2/CCl4 d.CH3COOH