26.某兴趣小组对如何延长硫酸亚铁溶液的保质期展开了研究。
(1)制备硫酸亚铁溶液,最合适的试剂组为___________(填编号);
a.过量铁屑和稀硫酸 b.过量稀硫酸和铁屑 c.过量硫酸铁溶液和铁屑
(2)实验室保存硫酸亚铁溶液的一般方法是_____________________________________;
该兴趣小组取等体积的硫酸亚铁溶液分别加入三个烧杯中,各滴入3 滴KSCN试剂,然后进行如下实验:
|
烧杯编号 |
① |
② |
③ |
|
加入试剂 |
铁粉0.1g |
铁粉0.1g,0.1mol/LH2SO43mL |
0.1mol/LH2SO43mL |
|
红色出现时间(天) |
1天 |
4天左右 |
8天以上 |
(3)在烧杯②中加入2种试剂后,即可观察到的现象为_____________________________;
(4)通过比较上述3组实验,可以得出的结论为___________________________________;
(5)硫酸亚铁溶液在空气中易氧化,氧化产物易水解生成Fe(OH)3,导致溶液酸性增大。
①试用一个离子方程式表示上述反应过程中的变化_________________________;
②硫酸亚铁溶液在空气中变质的反应为可逆反应,试用化学平衡理论解释烧杯③出现红色最晚的原因____________________________________________________。
25.SO2与O2在催化剂作用下合成SO3的反应为:2SO2(g)+O2(g)  2SO3(g)。在容积均为1L的a、b、c、d、e五个密闭容器中均充入1mol O2和2mol SO2混合气体,控温。反应进行5min时,测得相关数据如下表:
2SO3(g)。在容积均为1L的a、b、c、d、e五个密闭容器中均充入1mol O2和2mol SO2混合气体,控温。反应进行5min时,测得相关数据如下表:
 容器温度 容器温度浓度 |
a容器 400℃ |
b容器 425℃ |
c容器 450℃ |
d容器 475℃ |
e容器 500℃ |
|
c(O2) |
0.8 |
0.6 |
0.3 |
0.5 |
0.7 |
|
c(SO3) |
0.4 |
0.8 |
1.4 |
1.0 |
0.6 |
(1)反应进行5min内,五个容器中平均反应速率最大的是_______________(填容器编号);
(2)计算a容器中O2的反应速率_________________;

 (3)写出该反应的平衡常数表达式K=___________________,比较上表中数据,推测可能达到平衡的容器是_____________(填容器编号);
(3)写出该反应的平衡常数表达式K=___________________,比较上表中数据,推测可能达到平衡的容器是_____________(填容器编号);
(4)该反应是________(填“放热”、“吸热”)反应,在右图坐标中画出e容器中SO3的物质的量随时间的变化曲线。
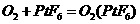 ,已知
,已知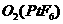 为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是
为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是
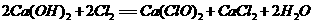
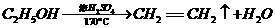
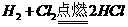
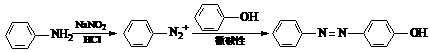
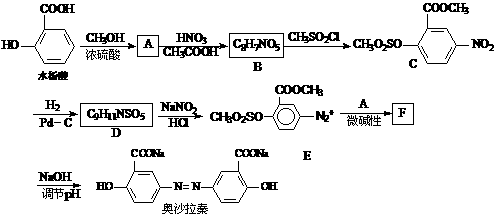
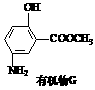 (6)有机物G(结构简式见下图)也可用于合成奥沙拉秦。它的一种同分异构体X是
(6)有机物G(结构简式见下图)也可用于合成奥沙拉秦。它的一种同分异构体X是 -氨基酸,能与FeCl3发生显色反应,其分子中共有6种化学环境不同的H原子。X的结构简式为________________
-氨基酸,能与FeCl3发生显色反应,其分子中共有6种化学环境不同的H原子。X的结构简式为________________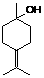 烯烃中碳碳双键是重要的官能团,在不同条件下能发生多种变化。异松油烯是应用广泛的工业原料,它与水反应(摩尔比1:1)可得到γ-松油醇(结构见右图)。
烯烃中碳碳双键是重要的官能团,在不同条件下能发生多种变化。异松油烯是应用广泛的工业原料,它与水反应(摩尔比1:1)可得到γ-松油醇(结构见右图)。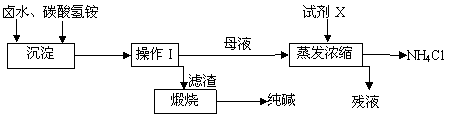

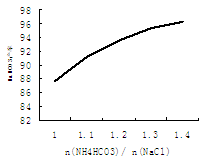 (5)碳酸氢铵与氯化钠的配料比是影响纯碱质量的因素之一,右图是(摩尔比)对NaHCO3产率的影响。实际生产中选择=1.2。
(5)碳酸氢铵与氯化钠的配料比是影响纯碱质量的因素之一,右图是(摩尔比)对NaHCO3产率的影响。实际生产中选择=1.2。