6.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实解释正确的是
|
|
现象 |
解释 |
|
A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
Cl2能与淀粉发生显色反应 |
|
B |
浓HNO3在光照条件下变黄 |
浓HNO3不稳定,生成棕色NO2能溶于浓硝酸 |
|
C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
说明该溶液中含有SO42- |
|
D |
向盐酸中加入浓硫酸时产生白雾 |
说明浓硫酸具有脱水性 |
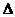 H=-2165 kJ/mol
H=-2165 kJ/mol 2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法不正确的是
2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法不正确的是 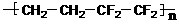 )是由两种单体加聚而成的
)是由两种单体加聚而成的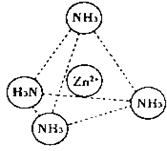
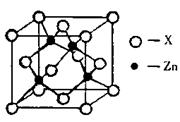
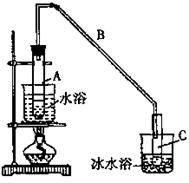 已知:
已知: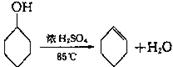

 ①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,分液后用
(填入编号)洗涤。
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,分液后用
(填入编号)洗涤。