24.(17分)硫酸是化学工业最重要的产品之一,工业制法如下:
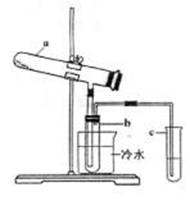 (1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:
|
2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O。
其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图
所示装置模拟用绿矾制硫酸的实验,并检验生成的硫
酸和二氧化硫(加热装置已略去)。其中b为干燥的
试管。
①化管b中得到的主要产物是 ,
②为检验反应的另一种生成物,试管c中应加入的试
剂是 。简述相应的实验现象及结论
。
③所得硫酸的理论浓度(溶质的质量分数)为 。
(2)目前,我国采用“接触法”制硫酸,设备如图所示:
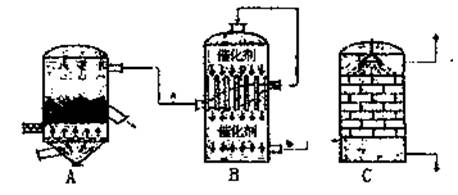
①接触室中两层催化剂中间的设备名称是 ,从A中出来的气体经净化、干燥后进入B中的气体化学式为 。
①有关接触法制硫酸的下列说法中,不正确的是 。
A.二氧化硫的接触氧化在合成塔中发生。
B.吸收塔得到的硫酸浓度为98%。
C.煅烧黄铁矿时,若FeS2损失了2%,则S损失4%。
D.B装置中反应的条件之一为较高温度,这是为了提高SO2的转化率。
(3)工业生产中,煅烧含硫48%的黄铁矿2吨,若在整个生产过程中,硫元素的损耗率为4%。则可生产出98%的浓硫酸 吨。
21.(14分)有一白色固体混合物,可能含有的阴、阳离子分别是
|
阳离子 |
K+ Ba2+ Ag+ Mg2+ Na+ |
|
阴离子 |
SO42-
SO32-
CO32-
AlO2- |
为了鉴定其中的离子,现进行如下实验,根据实验现象,填写下列空白:
(1)取该粉末,加水后得到无色溶液,用pH试纸测得溶液的pH为12。由此推断可知该物质中一定不存在的离子有 。
(2)向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有无色无味气体逸出。由此推断可知该物质中一定存在的离子有 ,一定不存在的离子有 。请写出反应过程中所有可能反应的离子方程式 。
(3)通过以上两步实验,仍然有些离子不能检出。假如让你设计相关实验检验其中的阳离子,你所用的方法是 ,必须用到的玻璃仪器有 。
 pC。t秒末,A减少了1mol, B减少了1.25 mol, C增加了0.5mol。则m:n:p应为 ( )
pC。t秒末,A减少了1mol, B减少了1.25 mol, C增加了0.5mol。则m:n:p应为 ( )
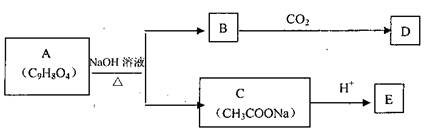 23.(11分)A为药用有机物,A的转化关系如图所示。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基连在相邻的碳原子上,D能跟NaOH溶液反应。
23.(11分)A为药用有机物,A的转化关系如图所示。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基连在相邻的碳原子上,D能跟NaOH溶液反应。 19.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量关系可表示为 ( )
19.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量关系可表示为 ( )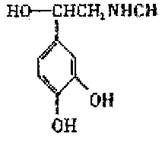 20.肾上腺素可用于支气管哮喘过敏性反应,其结构简式如下。下列关于肾上腺素的叙述正确的是 ( )
20.肾上腺素可用于支气管哮喘过敏性反应,其结构简式如下。下列关于肾上腺素的叙述正确的是 ( )