网址:http://m.1010jiajiao.com/timu3_id_403771[举报]

(1)已知:C(s)+
| 1 |
| 2 |
| 3 |
| 2 |
请写出C还原Fe2O3生成CO的热化学方程式
(2)反应2CO+O2
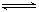 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2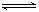 2Fe2O3的平衡常数K2,则反应3CO+Fe2O3
2Fe2O3的平衡常数K2,则反应3CO+Fe2O3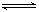 2Fe+3CO2的平衡常数K与K1、K2的关系式
2Fe+3CO2的平衡常数K与K1、K2的关系式
|
|
(3)高温下,氧化铁能跟碳发生下列反应:
①Fe2O3+3C
| ||
| ||
| n(C) |
| n(Fe2O3) |
| n(C) |
| n(Fe2O3) |
| n(C) |
| n(Fe2O3) |
(4)氯化炉中生成的气体,通常用碱性的亚硫酸钠溶液来吸收,请用离子方程式分析亚硫酸钠溶液呈碱性的原因
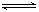 HSO3-+OH-
HSO3-+OH- HSO3-+OH-
HSO3-+OH-(5)氯化炉中发生:3Cl2(g)+3C(s)+Al2O3(s)
 2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是
2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是①增加C的量 ②多通入Cl2③升高温度 ④移走部分AlCl3(g) ⑤使用合适的催化剂工业上还常采用向氯化炉中通入O2的方法,其目的是
(6)沉淀分析法一般规定:溶液中某离子物质的量浓度低于1.0×10-5mol/L时,可认为已沉淀完全.现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2mol/L.此时所得沉淀中

(1)AlCl3是
(2)化炉中Al2O3、C12和C反应的化学方程式是
| ||
| ||
(3)冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,写出此反应的离子方程式是
(4)华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是
(5)为测定无水AlCl3产品的纯度,现称取16.25g精制后的无水 AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.32g. 则AlCl3产品的纯度为
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业制备无水AlCl3的流程如下:

(1)已知:C(s)+O2(g)=CO(g) ; △H=-110.5kJ·mol-1 ①
2Fe(s)+O2(g)=Fe2O3(s) ;△H=-822.1kJ·mol-1 ②
请写出C还原Fe2O3生成CO的热化学方程式:
。
(2)氯化炉中通入O2的目的是 。
(3)氯化炉中Al2O3、C12和C反应的化学方程式是 。
(4)氯化炉中导出的气体,通常用亚硫酸钠溶液来吸收,请写出用Na2SO3溶液处理尾气时发生反应的离子方程式 。
(5)在升华器中加入铝粉的目的是 。
查看习题详情和答案>>无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按下图所示流程进行一系列反应来制备无水AlCl3。

(1)氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则AlCl3是: 晶体,其结构式为: 。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式是 。
(3)冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,此反应的离子方程式为: 。
(4)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是: 。
(5)AlCl3产品中Fe元素含量直接影响其品质,为测定产品中Fe元素的含量,现称取16.25g无水AlCl3产品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重残留固体质量为0.32g。则产品中Fe元素的含量为: 。
查看习题详情和答案>>
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按下图所示流程进行一系列反应来制备无水AlCl3。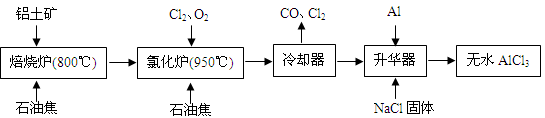
(1)氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则AlCl3是: 晶体,其结构式为: 。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式是 。
(3)冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,此反应的离子方程式为: 。
(4)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是: 。
(5)AlCl3产品中Fe元素含量直接影响其品质,为测定产品中Fe元素的含量,现称取16.25g无水AlCl3产品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重残留固体质量为0.32g。则产品中Fe元素的含量为: 。