27.(10分)氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)氮原子核外电子运动状态共有_____种,L层P电子比S电子多____个
(2)砷原子核外电子排布式为________________________________________
(3)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为_________________,该化学键能够形成的原因是________________________________
|
|
CH4 |
SiH4 |
NH3 |
PH3 |
|
沸点(K) |
101.7 |
161.2 |
239.7 |
185.4 |
|
分解温度(K) |
873 |
773 |
1073 |
713.2 |
(4)已知:
分析上表中四种物质的相关数据,请回答:
① CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是____________________________
② CH4和SiH4比较,分解温度高低的原因是________________________
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时__________先液化。
(5)氮化碳结构如右图,其中β-氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。
 ①写出氮化碳的化学式_________
①写出氮化碳的化学式_________
②指出氮化碳的晶体类型_________
21.(12分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀
碘化亚铁溶液中,加入1-2滴氯水,振荡后溶液呈黄色。请回答下列问题:
(1)探究课题:Fe2+、I- .
(2)猜想:
①甲同学认为还原性:Fe2+= I-,故上述实验现象:溶液呈黄色是含 (填化学式,下同)所致。
②乙同学认为还原性:Fe2+> I-,故上述实验现象:溶液呈黄色是含 所致。
③丙同学认为还原性:I-> Fe2+,故上述实验现象:溶液呈黄色是含 所致。
(3)实验设计
丁同学为了得出正确结论,选用下列某些试剂设计出两种方案进行实验供选用的试剂:
a. 酚酞试液 b. 四氯化碳 c. 无水酒精 d. 硫氰化钾溶液
请你在下列表格中写出丁同学选用的试剂、实验中观察到的现象及结论。(试剂填序号)
|
|
选用试剂 |
实验现象 |
结论 |
|
方案1 |
|
|
|
|
方案2 |
|
|
(4)应用与拓展:
①在足量的稀溴化亚铁溶液中,加入1~2滴氯水,溶液呈黄色所发生的离子反应方程式为
②在100mL碘化亚铁溶液中通入2.24L Cl2(标准状况),溶液中有1/3的Fe2+被氧化成单质Fe3+,则原碘化亚铁溶液的物质的量浓度为

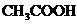 B.
B.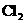 C.
C.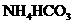 D.
D.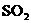

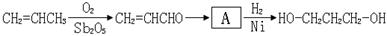
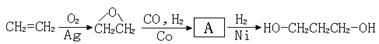

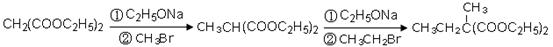
 利用该反应原理,以丙二酸二乙酯、1,3-丙二醇、乙醇为原料合成
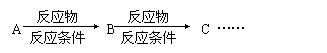
利用该反应原理,以丙二酸二乙酯、1,3-丙二醇、乙醇为原料合成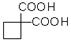 ,请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
,请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下: ②下列关于三聚氰胺的说法中,正确的有_____(填序号,多选扣分);(3分)
②下列关于三聚氰胺的说法中,正确的有_____(填序号,多选扣分);(3分)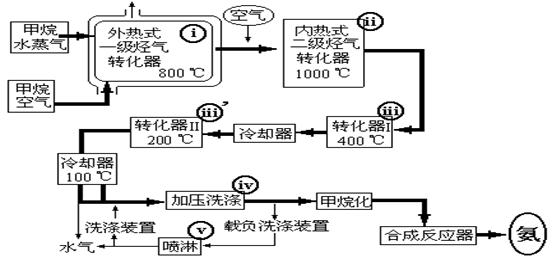
 CO2+H2 △H<0
CO2+H2 △H<0 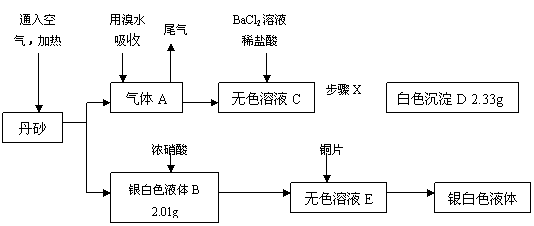 (12分)我国古代道士炼丹时得到了一种红色的丹砂,被他们认为是长生不老的灵丹妙药,曾献给皇上服用,结果……。某学校化学课外活动小组在资料上得到了丹砂是由两种元素组成的化合物。为探究丹砂的成分,他们称取w g丹砂并设计出了下列实验方案:
(12分)我国古代道士炼丹时得到了一种红色的丹砂,被他们认为是长生不老的灵丹妙药,曾献给皇上服用,结果……。某学校化学课外活动小组在资料上得到了丹砂是由两种元素组成的化合物。为探究丹砂的成分,他们称取w g丹砂并设计出了下列实验方案:
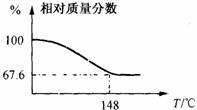 (11分)Na2CO3和H2O2结合成棒状晶体,Na2CO3·xH2O2(过氧化氢合相当于水合)可消毒、漂白或作O2源…。现称取一定质量的晶体加热。实验结果以温度和相对质量分数示于右图。
(11分)Na2CO3和H2O2结合成棒状晶体,Na2CO3·xH2O2(过氧化氢合相当于水合)可消毒、漂白或作O2源…。现称取一定质量的晶体加热。实验结果以温度和相对质量分数示于右图。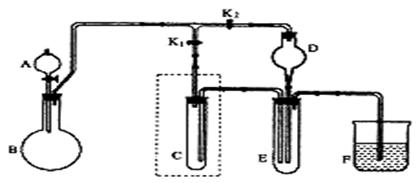 (11分)某学校化学课外活动小组的同学设计了如图所示的实验装置(夹持仪器略),并用其进行下述实验:
(11分)某学校化学课外活动小组的同学设计了如图所示的实验装置(夹持仪器略),并用其进行下述实验: ⑧分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积前者少,后者多。
⑧分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积前者少,后者多。