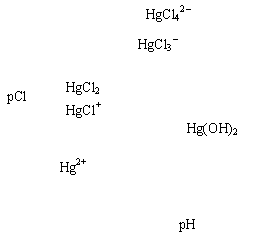
27. (10分)为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准。下表有A至I共九种气体在大气中的体积百分比及其温室效应指数。
|
选项 |
物质 |
大气中的含量(体积百分比) |
温室效应指数 |
|
A |
N2 |
78 |
0 |
|
B |
O2 |
21 |
0 |
|
C |
H2O |
1 |
0.1 |
|
D |
CO2 |
0.03 |
1 |
|
E |
CH4 |
2×10-4 |
30 |
|
F |
N2O |
3×10-5 |
160 |
|
G |
O3 |
4×10-6 |
2000 |
|
H |
CCl3F |
2.8×10-8 |
21000 |
|
I |
CCl2F2 |
4.8×10-8 |
25000 |
结合表中列出的九种气体,试参与回答下列各题:
(1)上表中A-E五种物质中,属于由极性键形成的极性分子的是 。
(2)下列说法不正确的是 。
A.N2O与CO2,CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,但却是强温室气体,下列推测不正确的是 。
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
(4)水能与多种过渡金属离子形成络合物。
已知某红紫色络合物的组成为CoCl3·5NH3·H2O。该络合物中的中心离子钴离子在基态时核外电子排布式为: ,作为配位体之一的NH3分子的空间构型为 。
(三)设计方案,实施探究
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯,浸泡一段时间。对可能产生的现象有如下假设:
假设①:有明显现象;
假设②:无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是 。
(5)基于假设②,结论是 ,请设计实验进一步验证该结论,叙述实验操作:
。
20. (12分)在现代生活中,人们越来越注意微量元素的摄入。碘元素对人体健康有着至关重要的作用。为预防碘缺乏病,我国卫生部规定每千克食盐中应含有40~50 mg KIO3。下表是某超市出售的加碘精制盐的有关说明:
|
产 品 标 准 号 |
GB5461-2000 |
|
配 料 表 |
氯化钠、碘酸钾、抗结剂 |
|
氯化钠含量 |
≥98.5% |
|
含 碘 量(以I计) |
20-50mg/kg |
|
储 藏 方 法 |
密闭、避光、防潮 |
|
食 用 方 法 |
待食品熟后加入 |
|
包装日期 |
见打印批号 |
某同学设计实验验证此食盐中是否含碘和检查该食盐是否为合格产品。
(1) 完成下列实验报告:
|
实验步骤 |
实验现象 |
实验结论(步骤2用离子方程式表示) |
|
1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡。 |
固体完全溶解 |
食盐及碘酸钾都能溶于水 |
|
2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡。 |
溶液出现棕黄色 |
|
|
3.再向上述溶液中滴加淀粉溶液,振荡。 |
溶液变成蓝色 |
|
(2)加碘食盐的包装袋上标有食用方法:待食品熟后加入。其原因是:
(3)该同学取该食盐样品100.0 g完全溶解于水中,然后加入用盐酸酸化的淀粉-KI溶液,结果溶液呈蓝色,则反应的离子方程式为
。为进一步确证样品是否为合格产品,该同学又用0.010 mol·L-1的Na2S2O3溶液滴定,当用去12.00 mL时蓝色刚好褪去(反应方程式为I2+2S2O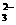 = 2I-+S4O
= 2I-+S4O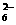 ),通过计算该加碘食盐中KIO3的含量为 mg/kg。由此可判定该食盐为
(填“合格”或“不合格”)产品。
),通过计算该加碘食盐中KIO3的含量为 mg/kg。由此可判定该食盐为
(填“合格”或“不合格”)产品。
(4)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O KIO3+3H2↑,则阳极的电极反应式为
;阴极附近pH值 (填“增大”、“减小”、“不变”)。
KIO3+3H2↑,则阳极的电极反应式为
;阴极附近pH值 (填“增大”、“减小”、“不变”)。
21. (10分)某化学兴趣小组为探索工业废料的再利用,在实验室中用含有铝、铁、铜的合金制取氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体。其实验方案如下:
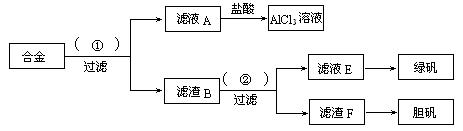
(1)所加试剂①、②分别是 。
(2)从滤液E中得到绿矾晶体的实验操作是
;从滤渣F制取胆矾的第一步操作最好采用 。
(3)上述实验方案中,有一步设计明显不合理,请你予以指出,并说明理由
。你认为正确的设计方案是
。
 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。 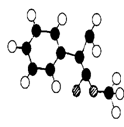 (3)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如
(3)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如
 (9分)有机物A的结构简式为
,它可通过不同化学反应分别制得B、C、D和E四种物质。
(9分)有机物A的结构简式为
,它可通过不同化学反应分别制得B、C、D和E四种物质。



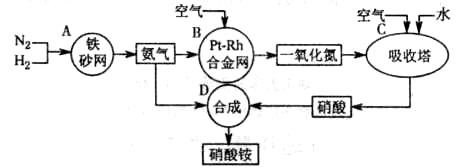
 2NH3(g) △H=-92
kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
2NH3(g) △H=-92
kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)