18.(8分)不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大 ,其原子吸引电子能力越强,在的形成的化学键中成为带负电荷的一方,下面是某些短周期元素的x值;
|
元素素素素 |
Li |
Be |
B |
C |
O |
F |
|
x值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
|
元素 |
Na |
Al |
Si |
P |
S |
Cl |
|
x值 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
(1)推测x值与原子半径的关系是 ;
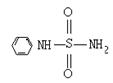
(2)某有机化合物结构式为H2N ,其中S-N中,你认为共用电子对偏向 。
(3)经验规律告诉我们:当成键的两原子相应元素的x差值(Δx)即Δx>1.7时,一般为离子键,Δx < 1.7,一般为共价键,试推断:BeCl3中化学键类型是 。
(4)预测元素周期表中x值最小的元素的位置 (放射性元素除外)。
|
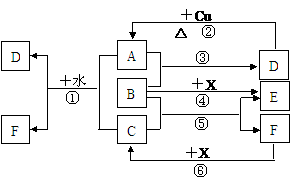 19.(12分)已知A-F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。试回答下列问题:
19.(12分)已知A-F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。试回答下列问题:
(1)根据图中信息,B、C、D、X氧化性从强到弱的顺序是(用化学式表示)
。
(2)B物质在生活中的一种用途 。
(3)写出反应③的化学方程式: 。
(4)写出反应⑥的离子方程式: 。
10.下列离子方程式书写正确且表示的是复分解反应的是 ( )
A.向硫代硫酸钠溶液中滴加稀硫酸:2H++S2O32-=S↓+SO2↑+H2O
B.等物质的量浓度的氯化铝溶液与烧碱溶液按体积比1:4混合:
Al3++4OH-=AlO2-+2H2O
|
D.向硫酸铵溶液中滴加氢氧化钡溶液:Ba2++SO42-=BaSO4↓
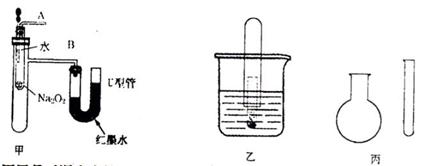 20.(16分)“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验。因其具有许多优点,已被广泛应用于化学实验中。下列三个实验均为“套管实验”,请观察、分析,回答下列问题:
20.(16分)“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验。因其具有许多优点,已被广泛应用于化学实验中。下列三个实验均为“套管实验”,请观察、分析,回答下列问题: 和
和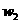 分别表示浓度为amol·L-1和bmol·L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小) ( )
分别表示浓度为amol·L-1和bmol·L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小) ( )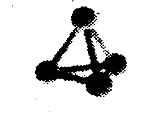 13.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示,已知断裂1molN-N键吸收167kJ热量,生成1molN≡N键放出942kJ热量,根据以上信息和数据,下列说法正确的是 ( )
13.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示,已知断裂1molN-N键吸收167kJ热量,生成1molN≡N键放出942kJ热量,根据以上信息和数据,下列说法正确的是 ( )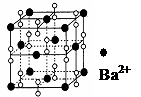 14.钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如下图所示,有关说法正确的是
14.钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如下图所示,有关说法正确的是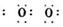 B.晶体的化学式为Ba2O2
B.晶体的化学式为Ba2O2