11.(10分)在一固定体积的密闭容器中,在850℃时发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g); △H=-41.2kJ/mol。容器内各物质的浓度(mol/L)变化如下(在850℃其化学平衡常数K=1.0)。
CO2(g)+H2(g); △H=-41.2kJ/mol。容器内各物质的浓度(mol/L)变化如下(在850℃其化学平衡常数K=1.0)。
|
时间/min |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
(1)下列可以作为判断该反应已经达到化学平衡状态依据的是 。
a.容器内压强不变 b.v正(H2) = v逆(CO)
c.混合气体中CO2的浓度不变 d.c(CO2) = c(CO)
(2)若在850℃时向反应容器中充入H2O(g),K值 (填“增大”、“减小”或“不变”,下同);若升高反应体系的温度,K值 。
(3)上表中:c1 = mol/L,H2O (g)的转化率为 。
10.(12分)测定含I-浓度很小的碘化物溶液时,利用振荡反应进行化学放大,可以准确求出原溶液中I-的浓度。主要步骤如是:
①取100mL样品溶液,用单质溴将样品中的I-氧化成IO3-,将过量的溴除去。
②再加入过量的KI,并用硫酸酸化,使IO3-完全转化成I2。
③将②中生成的碘完全萃取后,用肼将其还原成I-。
④将生成的I-萃取到水层后,用步骤①的方法再处理转化为IO3-。
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化,使IO3-完全转化成I2。
⑥将⑤得到的溶液完全转入250mL容量瓶,并加水稀释至刻度。
⑦分别取⑥得到的溶液25.00mL于锥形瓶中,加入指示剂,用0.1010mol/L 的Na2S2O3标准溶液滴定(2Na2S2O3+I2=Na2S4O6+2NaI)。 ⑧重复操作⑦两次。
根据上述步骤回答下列问题:
(1)在操作①中,除去过量溴单质的方法是 。
(2)请写出操作②中发生的反应的离子方程式 。
(3)在萃取操作中,使用的玻璃仪器有 。步骤⑦使用的指示剂是 ;判断滴定达到终点的现象为 。
(4)下表是该实验的记录结果:
|
滴定 次数 |
待测溶液的体积 |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 |
1.02 |
21.05 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.11 |
20.09 |
原溶液中I-的物质的量浓度为 。
 [AgI2]-。
[AgI2]-。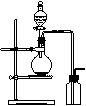 可用右图装置制取(必要时可加热)和收集的气体是( )
可用右图装置制取(必要时可加热)和收集的气体是( )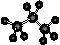
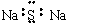 下列化学用语表达正确的是 ( )
下列化学用语表达正确的是 ( )