网址:http://m.1010jiajiao.com/timu3_id_385000[举报]
 CO(g) + H2O(g) 其平衡常数K和温度t的关系如下
CO(g) + H2O(g) 其平衡常数K和温度t的关系如下
(2)该反应的正反应为______________反应(“吸热”或“放热”);
(3)能判断该反应是否已经达到化学平衡状态的是:_______________
A.容器中压强不变
B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆
D.c(CO2) = c(CO)
(4)在850℃时,可逆反应:CO2(g) + H2(g)
 CO(g) + H2O(g),在该容器内各物质的浓度变化如下
CO(g) + H2O(g),在该容器内各物质的浓度变化如下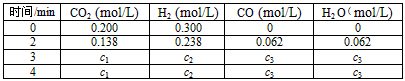
Ⅱ.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应

(5)新工艺的总反应为:3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g) ΔH 该反应ΔH=______________。
CH3OCH3(g)+CO2(g) ΔH 该反应ΔH=______________。 (6)增大压强,CH3OCH3的产率____________(填“增大”、“减小”或“不变”)。
(7)原工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生。新工艺中反应③的发生提高了CH3OCH3的产率,原因是_________________________。
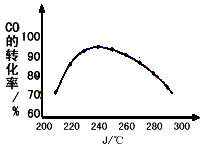
(8)为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气组成、压强、反应时间等因素不变,试验结果如下图CO转化率随温度变化的规律是_________________________________,原因是_________________________。
一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:2A(g)+B(s) 2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
|
|
实验Ⅰ |
实验Ⅱ |
实验Ⅲ |
|
反应温度/℃ |
800 |
800 |
850 |
|
c(A)起始/mol·L-1 |
1 |
2 |
1 |
|
c(A)平衡/mol·L-1 |
.0.5 |
1 |
0.85 |
|
放出的热量/kJ |
a |
b |
c |
A.实验III的化学平衡常数K<1
B.实验放出的热量关系为b>2a
C.实验III在30min达到平衡时的速率v(A)为0.005mol• L-1·min-1
D.当容器内气体密度不随时间而变化时上述反应达到平衡
查看习题详情和答案>>
一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:2A(g)+B(s) 2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
| | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 800 | 800 | 850 |
| c(A)起始/mol·L-1 | 1 | 2 | 1 |
| c(A)平衡/mol·L-1 | .0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
A.实验III的化学平衡常数K<1
B.实验放出的热量关系为b>2a
C.实验III在30min达到平衡时的速率v(A)为0.005mol? L-1·min-1
D.当容器内气体密度不随时间而变化时上述反应达到平衡 查看习题详情和答案>>
(2012?房山区一模)一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:2A(g)+B(s)?2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是( )
|
工业上利用反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=Q kJ·mol―1,制备H2 。已知该反应的平衡常数K与温度的关系如图所示。
CO2(g)+H2(g) △H=Q kJ·mol―1,制备H2 。已知该反应的平衡常数K与温度的关系如图所示。

若在一容积固定的密闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系
如下表:
| t/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是 。
A.单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
(2)Q 0(填“>”、“=”或“<”)。
(3)若在850℃时向反应容器中充入H2O(g),K值 (填“增大”、“减小”或“不变”)。
(4)达平衡时CO2的反应速率 ,CO(g)的转化率为 。
查看习题详情和答案>>