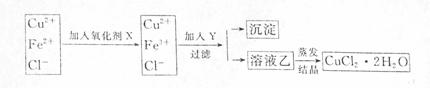
21.(16分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
C |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1) 不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸 。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2 (选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是 。
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)= mol·L-1
c(OH-)-c(HA)= mol·L-1
20.(12分)在一个固定容积的密闭容器中,进行如下化学反应:CO(g)+H2O(g) 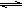 CO2(g)+H2(g);△H=QkJ·mol-1,其化学平衡常数K和温度t的关系如下
CO2(g)+H2(g);△H=QkJ·mol-1,其化学平衡常数K和温度t的关系如下
|
t/℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.25 |
请回答:
(1)上述反应中Q 0(选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是 。
a.容器中压强不变 b. △H不变
c. v正(H2)=v逆(CO) d.CO的质量分数不变
(3)温度为850℃时,可逆反应:CO(g)+H2O(g) 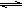 CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
850℃时各物质的浓度(mol·L-1) 变化
|
时间(min) |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c4 |
|
4 |
c1 |
c2 |
c3 |
c4 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
①计算:0-4min时v(CO)=________mol/(L·min),H2O(g)的转化率= 。
②反应在4min~5min间,平衡向逆反应方向移动,可能的原因是________(单选),表中5min~6min之间数值发生变化,可能的原因是___________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
 O2(g)
O2(g)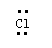
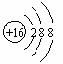 下列表达方式错误的是
下列表达方式错误的是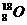 D、CO2分子的结构式:O=C=O
D、CO2分子的结构式:O=C=O 2NH3(g)。已知,在常温下,1g H2完全转化为NH3,放出的热量为15.4kJ。
2NH3(g)。已知,在常温下,1g H2完全转化为NH3,放出的热量为15.4kJ。