18.(2010上海卷)几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
X |
Y |
Z |
W |
|
原子半径/pm |
160 |
143 |
70 |
66 |
|
主要化合价 |
+2 |
+3 |
+5、+3、-3 |
-2 |
下列叙述正确的是
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成2W2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
13、几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
L |
M |
X |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6,-2 |
+2 |
-2 |
下列叙述错误的是( )
A、R的氧化物对应的水化物可能具有两性
B、X单质在氧气中燃烧不可能生成XO3
C、离子半径大小:r(M3+)>r(T2-)
D、L2+和X2-的核外电子数相等
 、
、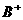 、
、 、D、E5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①
、D、E5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:① ;②
;② 。
。 的能力由强到弱的顺序是(用粒子的化学式表示)____________;这一顺序可用以下离子方程式加以说明:
的能力由强到弱的顺序是(用粒子的化学式表示)____________;这一顺序可用以下离子方程式加以说明: 、
、 ;
;
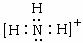 ;
;
 ;①
;① ;
;
 ;2:4构成的分子为N2H4,其结构式为
;2:4构成的分子为N2H4,其结构式为 。
。 Al2O3+3H2O。
Al2O3+3H2O。 型化合物,则X与Y 的原子序数之差可能为2或5
型化合物,则X与Y 的原子序数之差可能为2或5


