18.现有部分元素的性质与原子(或分子)结构如下表:
|
元素编号 |
元素性质与原子(或分子)结构 |
|
T |
最外层电子数是次外层电子数的3倍 |
|
X |
常温下单质为双原子分子,分子中含有3对共用电子对 |
|
Y |
M层比K层少1个电子 |
|
Z |
第3周期元素的简单离子中半径最小 |
(1)画出元素T的原子结构示意图____________。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是__________(填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式___________________________________________________________________。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素以原子个数比1∶2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式_______________________________________
________________________________________________________________________。
解析:由表中信息可知:T为氧元素,X为氮元素,Y为钠元素,Z为Al元素。Na比Al金属性强,相关实验事实为:与水反应Na比Al剧烈;最高价氧化物水化物的碱性NaOH比Al(OH)3强。上述元素中,由其中两种元素形成的既有离子键又有非极性共价键的物质常见的是Na2O2。氧元素与氢元素形成的原子个数比为1∶1的化合物Q是H2O2。氮元素与氢元素形成的原子个数为1∶2的化合物是N2H4,两者反应可生成N2和H2O。
答案:(1)  (2)Na c、d (3)Na2O2 (4)N2H4+2H2O2===N2+4H2O
(2)Na c、d (3)Na2O2 (4)N2H4+2H2O2===N2+4H2O
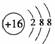
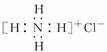
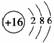 ;B项,电子式应为
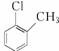
;B项,电子式应为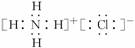 ;C项,正确;D项,对氯甲苯的结构简式为
;C项,正确;D项,对氯甲苯的结构简式为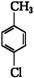 。
。 HS-+OH- HS-+H2O
HS-+OH- HS-+H2O
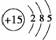 (2)①原子 ②氩原子 氯离子 硫离子 钾离子 钙离子 ③Al(OH)3+3H+===Al3++3H2O
(2)①原子 ②氩原子 氯离子 硫离子 钾离子 钙离子 ③Al(OH)3+3H+===Al3++3H2O (3)HNO3或HNO2 H2CO3或H2C2O4等有机酸
(3)HNO3或HNO2 H2CO3或H2C2O4等有机酸