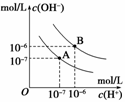
17.随着溶液酸碱性的变化,酚酞分子结构发生转化而显示不同颜色:无色酚酞结构A红色酚酞结构B。在化学实验课上,细心的某同学发现:当无色的酚酞溶液滴入到氢氧化钠溶液中时,溶液立刻变成红色,但是随后红色溶液又逐渐变成无色。对此,许多同学纷纷发表看法,主要有三种推测:①红色酚酞结构被空气中的氧气氧化;②溶液吸收了空气中的二氧化碳,pH减小,红色退去;③红色酚酞结构自动转化为另外一种无色酚酞结构C。
为此在老师的指导下,同学们做了如下实验。分别取4 mL不同浓度的NaOH溶液于试管中,滴加2滴酚酞溶液,实验现象与数据如下表:
|
编号 |
静置 方式 |
NaOH溶液浓度 |
滴入2滴酚酞溶液 |
加热至 沸腾 |
冷却 |
再加热至沸腾 |
冷却 |
滴入适量稀盐酸 |
|
① |
敞口 |
1% |
变红,30 min后退色 |
变红 |
退色 |
变红 |
退色 |
变红 |
|
② |
密闭 |
1% |
变红,29 min后退色 |
变红 |
退色 |
变红 |
退色 |
变红 |
|
③ |
敞口 |
5% |
变红,7 min后退色 |
变红 |
退色 |
变红 |
退色 |
变红 |
|
④ |
密闭 |
5% |
变红,30 min后退色 |
变红 |
退色 |
变红 |
退色 |
变红 |
|
⑤ |
敞口 |
10% |
变红,1/2 min后退色 |
变红 |
退色 |
变红 |
退色 |
变红 |
|
⑥ |
密闭 |
10% |
变红,1/2 min后退色 |
变红 |
退色 |
变红 |
退色 |
变红 |
请回答下列问题:
(1)通过分析表中数据及现象,该组同学认为第①种推测不合理。理由是________________________________________________________________________。
(2)第②种推测也不合理。理由是________________________________________________________________________。
(3)红色酚酞结构B转化为无色酚酞结构C是否为可逆反应:________(填“是”或“否”),在各个滴入适量稀盐酸又变红的试管中加入足量稀盐酸产生的现象是________________________________________________________________________,
原因是____________________________________________________________________。
(4)红色酚酞结构B的热稳定性比无色酚酞结构C的热稳定性要________(填“强”或“弱”),红色酚酞结构B转化为无色酚酞结构C是一个________(填“吸”或“放”)热的过程。
解析:如果是①被空气中O2氧化的原因的话,酚酞结构将发生变化,正如HClO氧化退色反应物质一样,不会出现反复加热冷却,出现反复的变红和退色。
如果是②CO2的原因的话,②④⑥静置方式为封闭,隔绝了CO2,所以也不正确,只能是③。
答案:(1)对已退色的溶液反复加热冷却,出现反复的变红和退色 (2)②④⑥组实验在密闭时变红的溶液仍能退为无色 (3)是 退为无色 加入足量盐酸,溶液酸性增强,主要以无色酚酞结构A的形式存在 (4)强 放