2.离子的检验和鉴别有多种方法,其中最常用的方法有以下三种:
|
检验方法 |
沉淀法 |
显色法 |
气体法 |
|
含义 |
反应中有沉淀产生或溶解 |
反应中有颜色变化 |
反应中有气体产生 |
下列离子检验的方法不合理的是( )
A.NH-气体法 B.I--沉淀法 C.Fe3+-显色法 D.Ca2+-气体法
解析:根据本题给出的三种方法的实质,Ca2+应该用沉淀法检验。
答案:D
17. 有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下:
|
② |
|
|
|
|
|
|
⑦ |
⑧ |
②与⑦、②与⑧形成的液体化合物是常见的重要溶剂,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:________________(用化学式表示)。
a
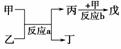
(2)若甲、乙、丙、丁、戊均为上述八种短周期元素中的某些元素组成的单质或由其中两种元素组成的化合物,且甲、戊为无色气体,反应a为置换反应,反应b为化合反应。如图所示转化关系,推测:戊可能为:________________、________________(列举合适的两例)。
若甲是O2、乙是N2H4,反应a是在强碱性溶液中进行的原电池反应,则负极发生的电极反应式为:_____________________________________________________________。
b
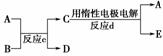
(3)若右图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物。已知:A是常见的金属单质,反应c为置换反应。若反应c是用A作电极,在B的水溶液中进行电解反应,它们有如右图示转化关系。则反应d中阴极的电极反应式为:__________________________________________________________。
若反应c是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物时,则反应c的化学方程式为:______________________________________。
解析:因②与⑦、②与⑧形成的液体化合物是常见的重要溶剂,结合其在元素周期表中的相对位置可以推出②为碳,⑦为硫,⑧为氯;其最高价氧化物对应水化物的酸性强弱的顺序是HClO4>H2SO4>H2CO3;(2)因反应a为置换反应,所以甲、乙、丙、丁四种物质中有两种是单质,两种是化合物,设甲为氧气,乙可能是氨气或硫化氢或甲烷等气态烃,丙则可能为氮气、硫或C,丁为水,戊为NO或SO2或CO、CO2等;若甲为CO2,则乙可能为Mg,丙可能为C,丁可能为MgO,戊可能为CO;若甲是O2、乙是N2H4,则在强碱性溶液中进行的反应a的原电池反应的负极反应式为N2H4+4OH--4e-―→N2+4H2O。(3)若反应c是用A作电极,在B的水溶液中进行电解反应的置换反应,结合反应d的生成物,可以确定A可能为铜等活动性相对较弱的金属,B的水溶液可能为硫酸、盐酸等酸溶液,C为可溶性铜盐或相应金属的盐溶液,D为氢气;若A为铜时,则反应d中阴极的电极反应式为Cu2++2e-―→Cu;若反应c是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物,可联想到铝热反应,其常见的化学方程式为Fe2O3+2Al2Fe+Al2O3。
答案:(1)HClO4、H2SO4、H2CO3 (2)CO、SO2、NO(任举两例,其他合理答案也可) N2H4+4OH--4e-―→N2+4H2O (3)Cu2++2e-―→Cu(或Zn2++2e-―→Zn、Ni2++
2e-―→Ni);Fe2O3+2Al2Fe+Al2O3
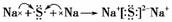
 NH3·H2O+H+ (5)ab
NH3·H2O+H+ (5)ab