例1.A是烃,B是烃的含氧衍生物,A、B均为常见有机物。由等物质的量的A和B组成的混合物0.05 mol在0.125 mol O2中恰好完全燃烧,生成0.1 mol CO2和0.1 mol H2O。试回答下列问题:
(1)混合物中A、B的分子组成可能有__________种组合。
(2)另取一种组合A和B,以任意比混合,且物质的量之和为a mol。
①若耗氧量一定,则A、B的分子式分别是A__________,B___________;耗氧量为___________mol(用a表示)。
②若生成的CO2和H2O的物质的量一定,则A、B的分子式分别是A_________,B______________;
③若生成CO2的量为定值,则生成物H2O的质量范围为____________(用a表示)。
分析:(1)由题意得出混和气体平均组成为C2H4O,所以有以下五种组合:(1)CH4, C3H4O2 (2)C2H4,C2H4O2 (3)C3H4,CH2O2 (4)C2H2,C2H6O2 (5)C3H6,CH2O2 。 (2)①为第4种组合,耗氧量为2.5a。②由题意得A、B分子中碳氢原子数相等,所以为第(2)种组合。③由题意得A、B分子碳原子数相等,则为第(2)与第(4)种组合,第(2)种组合中生成水的质量恒为36ag,而第(4)种组合中,生成水的质量最小为18ag,最大为54ag,所以答案为18a<mH2O<54a。
 |
|||
|
|||
|
 例2.已知:(1)RCH=CH2 RCH-CHO
例2.已知:(1)RCH=CH2 RCH-CHO


|
|
 (2)CH3-CH-COOR CH2=C-COOR
(2)CH3-CH-COOR CH2=C-COOR
有机物A~F中,A是链烃,A与H2加成得到烷烃,经测定该烷烃分子中有三个-CH2,它的一氯取代物有7种同分异构体。有关它们的其它信息如下:

(1)写出X的结构简式_______________________。
(2)写出化合物A、C、E的结构简式:A_______________
C______________ E______________
(3)写出B与足量的新制Cu(OH)2反应的化学方程式
__________________________________
答:(1) CH3OH (2)A、CH2=CH-CH2-CH2-CH2-CH=CH2

 C、CH3-CH-CH2-CH2-CH2-OH-CH3
C、CH3-CH-CH2-CH2-CH2-OH-CH3

 E、CH3-C=CH-CH2-CH=C-CH3
E、CH3-C=CH-CH2-CH=C-CH3
|

 (3)CH3-CH-CH2-CH2-CH2-CH-CH3+4Cu(OH)2--→
(3)CH3-CH-CH2-CH2-CH2-CH-CH3+4Cu(OH)2--→

 CH3-CH-CH2-CH2-CH2-CH-CH3+Cu2O↓+4H2O
CH3-CH-CH2-CH2-CH2-CH-CH3+Cu2O↓+4H2O
例3.乙酸在某催化剂的作用下可生成一种重要的有机试剂A。A中的氢原子没有差别,A中含有羰基,且分子里的所有原子均在同一平面上。A很容易与水反应重新变成乙酸。(1)写出A的结构式;(2)写出A与水反应的方程式;(3)写出A分别与NaOH、NH3和乙醇反应的方程式。



 ①乙酸→A A ③所有原子共平面
①乙酸→A A ③所有原子共平面
②分子中的氢原子 ④A+水→乙酸
无差别,含羰基
有的考生对比信息①④迅即发现,A是乙酸的脱水产物,即2CH3COOH→CH3COOCOCH3(乙酸酐)+H2O,且恰能满足信息②,但由CH4推想-CH3上的原子又觉得A分子里的所有原子决不可共平面。其实,脱水方式除分子间脱水还有分子内脱水,A正是乙酸分子脱水的产物:CH3COOH→CH2=C=O+H2O,CH2=C=O类似于乙烯,双键所连的原子能保证共平面,满足全部信息。
答案是:(1)A为CH2=C=O
(2)CH2=C=O+HOH→CH3COOH
(3)CH2=C=O+HONa→CH3COONa
CH2=C=O+HNH2→CH3COONH
CH2=C=O+HOCH2CH3→CH3COONH3
启示:有的考生认定A是乙酸酐,这是受思维定势的干扰。这种习惯于用已有的知识来套解未知的问题,不善于充分利用题目的全部信息,因而使思维的创新受阻,这不得不说是搞“题海战”的惨痛教训。
例4.化合物C的人工合成方法是:(1)在催化剂存在下甲醇与氨气反应得到A;(2)在催化剂存在下乙烯跟氧气反应得到B;(3)在水存在下A和B反应得到C。C的脱水产物的结构为CH2=CH-N(NH3)3OH。试写出A、B、C的结构简式。

 解析:本题未给出形成A、B的反应条件和具体物质,试图从正向推得C是很难的。但根据C的脱水产物,联想教材上碳碳双键加水反应的情况,并利用逆向推理,则可推得C,且有两种途径。再拆C可得A、B和水。这里涉及的反应尽管陌生,但只要方法得当,根据题给信息用有限知识是可以推得结果的。这是解信息题的又一技巧。即:
解析:本题未给出形成A、B的反应条件和具体物质,试图从正向推得C是很难的。但根据C的脱水产物,联想教材上碳碳双键加水反应的情况,并利用逆向推理,则可推得C,且有两种途径。再拆C可得A、B和水。这里涉及的反应尽管陌生,但只要方法得当,根据题给信息用有限知识是可以推得结果的。这是解信息题的又一技巧。即:
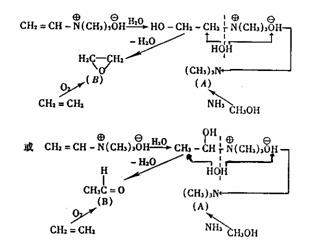
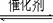 例1.在一定条件下,向一密闭容器中通入一定量SO2和O2的混合气体,即发生如下反应:2SO2(g)+O2(g)
2SO3(g);△H<0。反应达平衡后,SO2、O2和SO3的物质的量之比为3:4:6,保持其他条件不变,降低温度后达到新的平衡时,O2和SO3的物质的量分别是1.1 mol和2.0 mol,此时容器内SO2的物质的量应是
例1.在一定条件下,向一密闭容器中通入一定量SO2和O2的混合气体,即发生如下反应:2SO2(g)+O2(g)
2SO3(g);△H<0。反应达平衡后,SO2、O2和SO3的物质的量之比为3:4:6,保持其他条件不变,降低温度后达到新的平衡时,O2和SO3的物质的量分别是1.1 mol和2.0 mol,此时容器内SO2的物质的量应是
A、0.7 mol B、0.9 mol C、1.1 mol D、1.3mol
分析:2SO2+O2 2SO3
2SO3
起始:3a 4a ba
转化:2x x 2x
平衡:3a-2x 1.1 2.0

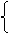 4a-x=1.1 解得: a=0.3
4a-x=1.1 解得: a=0.3
6a+2x=2.0 x=0.1
nSO2=3a-2x=0.7mol
例2.在一个体积可变的密闭容器中,盛有等物质的量的SO2、O2、SO3(g)的混合气体,在一定温度和压强下,反应达到平衡时,容器中混合气体的密度比反应前减少了1/13(温度、压强反应前后不变),则反应达到平衡时,混合气体中SO2占总体积的
A、1/3 B、1/6 C、2/13 D、6/13
分析:2SO2+O2 2SO3
2SO3
起始:1 1 1
转化:2x x 2x
平衡:1+2x 1+x 1-2x
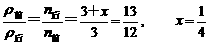
SO2%=
例3.将2 mol H2O和2 mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H2O(g) 2H2+O2, 2CO+O2
2H2+O2, 2CO+O2 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是____和_____,或___和____(填化学式)。
(2)若平衡时O2和CO2的物质的量分别为n(O2)平=a mol, n(CO2)平=b mol。试求n(H2O)平=_____(用含a、b的代数式表示)。
分析:2H2O 2H2+O2
2H2+O2
2CO+O2 2CO2
2CO2
 不可 H2O和H2 因为 H2O与H2
不可 H2O和H2 因为 H2O与H2
CO和CO2 CO与CO2的比值是定值
设第一步反应生成的O2的物质的量为x,第二步反应消耗的O2的物质的量为y.
2H2O 2H2+O2
2H2+O2
△n 2x 2x x
2CO+O2 2CO2
2CO2
△n 2y y 2y

∴
例4.加热硫酸铜晶体,随温度不断升高1000℃,晶体会逐渐“释放”水蒸气、三氧化硫(并会分解)、氧气,同时生成氧化铜,而最后氧化铜转化为氧化亚铜。现将25.0g CuSO4·5H2O均匀加热,缓慢升温到1000℃,并恒温一段时间。
试通过计算,回答下列问题:
(1)反应过程中,固体产物的质量是否可能为10g,________(填“可能”或“不可能”)。
(2)若实验没有误差,反应完全后,气体产除去水后,其物质的量n (气体)的取值范围为__________。
(3)某同学在实验中最后获得固体的质量为7.6g,试计算该同学获得固体物质的组成成分和它们的质量。
思路分析:25.0gCuSO4·5H2O的物质的量为0.100mol
|
|
CuSO4====CuO+SO3↑
在某中间温度时,若产物全是CuSO4,其质量为:0.1×160=16(g),若产物全是CuO时,其质量为0.1×80=8.0(g)
因此,当剩余固体质量为10g,其组分既有CuSO4(设其质量为x),又有CuO,根据Cu原子守恒可得:
 解得x=4.0(g)
解得x=4.0(g)
则CuO质量为:10g-4.0g=6.0g
|
 2SO2+O2,若前为三氧化硫,则气体物质的量为0.125mol,若三氧化硫完全分解,则气体物质的量为0.175mol,所以0.125<n<0.175。
2SO2+O2,若前为三氧化硫,则气体物质的量为0.125mol,若三氧化硫完全分解,则气体物质的量为0.175mol,所以0.125<n<0.175。
(3)若全是氧化铜,则最后固体质量为8.0g,若全是氧化亚铜,则质量为7.2g,现固体质量为7.6g,说明剩余固体中既有CuO(设其质量为xg),又有Cu2O(设其质量为yg)。
x+y=7.6
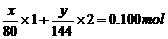
解得:x=4.0g, y=3.6g。
例5.在10℃和4.00×105 Pa的条件下,反应aA(g)  dD(g)+eE(g)建立平衡后,保持温度不变,改变压强。下表列出了不同压强下反应建立平衡后物质D的浓度(在改变压强过程中无其它副反应发生):
dD(g)+eE(g)建立平衡后,保持温度不变,改变压强。下表列出了不同压强下反应建立平衡后物质D的浓度(在改变压强过程中无其它副反应发生):
|
压强(Pa) |
4.00×105 |
6.00×105 |
1.00×106 |
2.00×106 |
|
c(D)(mol/L) |
0.0850 |
0.126 |
0.200 |
0.440 |
(1)从表中数据分析,压强从4.00×105Pa增加到6.00×105Pa时,平衡向___反应方向移动(填“正”或“逆”),理由是___________________。
(2)压强从1.00×106Pa增加到2.00×106Pa时,平衡向____方向移动,试推断此时平衡向该方向移动的两个必要条件为________________________________。
6.谨防因一字之差落入“陷阱”
在审题时,看清题干中的每一个字,特别是关键信息,谨防粗心大意,而落人“陷阱”.
例1 在25℃时,将2个铜电极插入到一定的Na2S04饱和溶液中,通直流电电解并不断搅拌,当阴极上收集到a mol的气体的同时,溶液中析出了b mol的结晶水合物Na2S04·10H20,若保持温度不变,则所剩溶液中溶质的质量分数是( ).
A. B.
B. 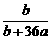 C.
C. D.
D.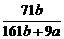
|
电解时总的化学反应方程式为:Cu十2H20=====Cu(OH)2↓十H2↑
阴极逸出a molH2,水被电解了2a mol,根据溶解度知识,不难求出答案为C,如果将
|
2H20=====2H2↑+O2↑
阴极逸出a mol H2,水被电解了a mol,其答案为D.
可见因一字之差(“铜”与“铂”),答案各异。
 A、乙醚和乙醇 B、乙醚和水 C、乙醇和水 D、乙醛和丁醇
A、乙醚和乙醇 B、乙醚和水 C、乙醇和水 D、乙醛和丁醇



 例3.某溶液中含HCO3-、SO32-、CO32-、CH3COO-等四种阴离子,若向其中加入足量Na2O2后(设溶液体积不变),溶液中上述离子浓度基本保持不变的是
例3.某溶液中含HCO3-、SO32-、CO32-、CH3COO-等四种阴离子,若向其中加入足量Na2O2后(设溶液体积不变),溶液中上述离子浓度基本保持不变的是 2HNO2+NO;△H<0,为加快此反应的反应速率,下列措施可行的是
2HNO2+NO;△H<0,为加快此反应的反应速率,下列措施可行的是