[例题6]氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法不正确的是
A.该反应既是分解反应,又是氧化还原反应
B.变蓝的淀粉碘化钾试纸褪色可能发生的反应:
5C12+I2+6H2O=12H++10Cl-+2IO3-
C.若化学计量数a=8,b=3,则该反应转移电子数为20e-
D.氯酸分解所得O2和Cl2的物质的量之比是确定不变的
解析: O2和HClO4是氧化产物,C12是还原产物,生成HClO4的多少不同会导致反应所得O2和C12的物质的量之比的变化
答案:D
[例题7]某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a ,将其全部投入50mLbmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法不正确的是( )
A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若80y(1-a/3)≥b≥160y/3,则金属和硝酸恰好完全反应
D.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
14.BD解析:A中,滴加硫酸后,溶液中的NO3-在酸性条件下,能氧化剩余的金属.B中,当金属全部溶解时,铁元素可能以Fe2+的形式存在,不一定含Fe3+,B不正确。C中,根据反应式:3Cu+8HNO3=Cu(NO3)2
+2NO↑+4H2O ;3Fe+8HNO3=Fe(NO3)2+2NO↑+4H2O 。Fe+4HNO3=Fe(NO3)3+NO↑+2H2O ,利用极限法,当金属与硝酸恰好完全反应时,80y(1-a/3)≥b≥160y/3 ,C正确。D中,当b=0.3时,参加反应的硝酸为0.05×0.3=0.015mol,而生成的NO的物质的量为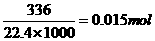 ,参加反应的硝酸的物质的量应该大于生成NO的物质的量,D不正确。
,参加反应的硝酸的物质的量应该大于生成NO的物质的量,D不正确。
[例题8]问题提出:小王同学有次实验时把SO2通入装有BaCl2、FeCl3的混合溶液的试管中,出现了白色浑浊物
假设、验证:
|
|
假设 |
实验验证方法及现象 |
|
假设1 |
白色浑浊物是BaSO3。 |
(1)_____________________________
__________________________________ |
|
假设2 |
(2)白色浑浊物是BaSO4,主要原因是
 |
反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中,不出现浑浊。滴加FeCl3溶液后出现浑浊 (4)通入纯净的CO2的目的_______________ |
请把上表填充完全.
(5)写出SO2通入BaCl2、FeCl3的混合溶液生成沉淀相关的离子方程式。
(a)
(b)___________________________________________________
|

(1) 在白色浑浊物中加入过量盐酸,变澄清 (1分)
(1分)
(2) Fe3+氧化了水中的SO2,在Ba2+作用下,生成BaSO4(1分)
(3)防止制备的SO2气体中混有空气(O2)对说明Fe3+氧化SO2造成干扰 (2分)
(2分)
(4) (a) SO2 +2Fe3++2H2O =SO42-+2Fe2++4H+(2分)
|

 例1.向甲乙两个容积均为1L的恒容容器中分别充入
例1.向甲乙两个容积均为1L的恒容容器中分别充入 xC(g);△H<0。测得两容器中C(A)随时间t的变化如右图所示,则下列说法中正确的是
( )
xC(g);△H<0。测得两容器中C(A)随时间t的变化如右图所示,则下列说法中正确的是
( )
 2H2SO4+2Cu+O2↑, 2H2O
2H2SO4+2Cu+O2↑, 2H2O