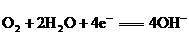12.T °C时气体A与气体B反应生成气体C和固体D。每1 mol A与足量B完全反应时生成1 mol D。反应过程中A、B、C浓度变化如图①所示。若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图②所示。则下列结论正确
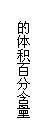 的是
的是
 A.该反应的化学方程式是
A+3B 2C+D A.该反应的化学方程式是
A+3B 2C+DB. T°C若向上述平衡体系中加入0.2 mol C,平衡时A的浓度大于0.3 mol/L C.升高温度,其它条件不变时,,正、逆反应速率均增大,且A的转化率增大 D.相同时间内,消耗0.1 mol/L A时,生成了0.3 mol/L B,反应达到平衡 13.二元酸H2A在水中发生电离:H2A=H++HA-和HA-  H++A2-,则下列几种物质的水溶液中关系式不正确的是
( ) H++A2-,则下列几种物质的水溶液中关系式不正确的是
( )A.NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+) B.NaHA:c(Na+)=c(A2-)+c(HA-) C.Na2A:c(Na+)>c(A2-) >c(OH-)>c(H+) D.H2A:c(H+)=c(HA-)+2 c(A2-)+c(OH-) 14.常温下,下列各组离子在指定环境下能大量共存的是 A.pH=l的溶液中:Na+、K+、SO32-、MnO4- B.pH=7的溶液中:Na+、A13+、Cl-、SO42- C.pH>12的溶液中:Na+、K+、SO42-、AlO2- D.pH=0的溶液中:Na+、K+、NO3-、ClO- 15.下列反应的离子方程式书写正确的是 A.小苏打溶液与氢氧化钠溶液反应:HCO3-+OH-=CO32-+H2O B.NaHSO4溶液与Ba(OH)2溶液混合后显酸性: Ba2++OH-+H++SO42-=BaSO4↓+H2O C.氧化亚铁溶液中滴加稀硝酸:Fe2++NO3-+2H+=Fe3++NO↑+H2O D.偏铝酸钠水解:AlO2-+2H2O  Al(OH)3↓+OH- Al(OH)3↓+OH-16.短周期元素A、B、C、D的原子序数依次增大,它们的原子最外层电子数之和为17,其中A、C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是 ( ) A.最高价氧化物对应的水化物的酸性:A<C<D B.A的氢化物的稳定性小于C的氢化物 C.原子半径:B>C>D D.A与D可形成离子化合物 17.镁铝合金5.1 g溶于300 mL2 mol/L的盐酸,在标准状况下放出气体的体积为5.6 L。向反应后的溶液中加入足量氨水,产生沉淀的质量为 A.5.1g B.10.2g C.13.6g D.15.3g 18.将2mol NaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后得到的固体,经测定Na2O2无剩余,则最后固体的物质的量为 ( ) A.1-2mol之间 B.1-4mol之间 C.2-4mol之间 D.大于4mol 答案 一、选择题(本题包括8小题,每小题4分,共32分)
|
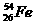 与
与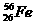 互为同位素
互为同位素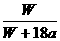 ×100%
B.
×100%
B.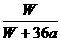 ×100%
×100% 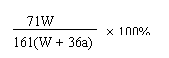
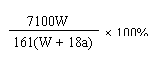
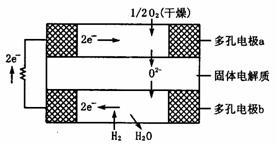
 )在其间通过.该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
)在其间通过.该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )