摘要:在中学化学高考试题中.命题人往往设置“陷阱 .它可以校正学生掌握知识不准确.考虑问题不全面等毛病.同时也对学生的解题能力提出了更高层次的要求.那么如何才能轻松地避开“陷阱 正确解题呢?以下从几个方面分析怎样避开“陷阱 顺利解题.供同学们参考.1.正确理解基本概念避开 陷阱 一些题目往往围绕化学概念设置“陷阱 .如果概念掌握不清.理解不透.就难逃一“劫 .因此.一定要吃准.吃透每一个概念. 例1 在加热氯酸钾制氧气时.在①锰.②二氧化锰.③高锰酸钾中.可以做催化剂的是( ). A.①② B.①②③ C.② D.②③ 分析 如果对催化剂的概念模糊不清.认为只要能使氯酸钾受热分解速率加快的物质就是该反应的催化剂.其中锰与氯酸钾受热分解产生的氧气反应生成二氧化锰.高锰酸钾的分解也能产生二氧化锰.以此掉进命题人设置的“陷阱 而选B.其实催化剂的概念包含两层意思: ①改变反应速率,②反应前后本身的质量和化学性质不变.由此得出本题答案为C. 例2 下列物质是非电解质的是( ). A.Cl2 B.NH3 C.NaCl D.CH3COOH 分析 此题很容易错选A,要答好这道题.首先要明确非电解质是:“溶于水和熔化状态下不能导电的化合物 .A选项不是化合物.因此不在被选之列.本题答案应为B. 例3.NH3氧化制HNO3时.在吸收塔里发生如下反应:3NO2+H2O2HNO2+NO;△H<0.为加快此反应的反应速率.下列措施可行的是 A.降低温度 B.升高温度 C.及时分离出NO D.增大吸收塔中的压强 例4.常温下.在饱和石灰水中加入下列固体物质.恢复到常温.溶液的pH一定不会发生改变的是 A.NaOH B.Ca(OH)2 C.CaO D.NaHCO3 例5.已知酸式盐NaHB在水溶液中存在下列反应: ①NaHB==Na++HB-.②HB-H++B2-.③HB-+H2OH2B+OH- 且溶液中c(H+)>c(OH-).则下列说法一定正确的是 A.NaHB为强电解质 B.H2B为强酸 C.H2B为弱电解质 D.HB-的电离程度小于HB-的水解程度
网址:http://m.1010jiajiao.com/timu3_id_53671[举报]
某光卤石样品中含有不跟氢氧化钠溶液、盐酸反应的杂质,学校化学课外活动研究小组欲测定此样品中KCl·MgCl2·6H2O的质量分数,经过讨论有多种实验方案.
请根据提供的实验试剂和仪器(所需的仪器在中学化学常用仪器中任选),设计并选择精确度较高的实验测定方案(说明选择的理由),对选定方案简要写出实验步骤和实验结果.
可选用的实验试剂:a mol/L NaOH溶液,b mol/L Na2CO3溶液,c mol/L盐酸,d mol/L AgNO3溶液,酚酞试液,紫色石蕊试液.
查看习题详情和答案>>(1)糖类、油脂、蛋白质能在人体中
(2)药物可以预防、诊断和治疗疾病,很多化学试剂具有消毒杀菌功效,在中学化学范围内,可作为药物的化学试剂很多,如氢氧化铝胶囊、碳酸氢钠粉剂等,写出氢氧化铝和碳酸氢钠分别与胃酸的主要成分作用的离子方程式:
查看习题详情和答案>>
氧化
氧化
(填“氧化”或“还原”),供给人体所需要的能量.其中油脂
油脂
是含热能最高的营养物质.根据溶解性的不同,维生素B类属于水
水
溶性维生素,维生素D 属于脂
脂
溶性维生素.某药品标签上贴有“OTC”符号,它表示非处方类药物
非处方类药物
.(2)药物可以预防、诊断和治疗疾病,很多化学试剂具有消毒杀菌功效,在中学化学范围内,可作为药物的化学试剂很多,如氢氧化铝胶囊、碳酸氢钠粉剂等,写出氢氧化铝和碳酸氢钠分别与胃酸的主要成分作用的离子方程式:
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+3H+=Al3++3H2O
、HCO3-+H+=CO2↑+H2O
HCO3-+H+=CO2↑+H2O
,因此可用来治疗胃酸过多
胃酸过多
.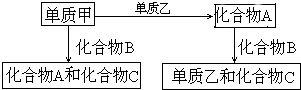 A、B、C是在中学化学中常见的三种化合物,它们各由两种元素组成,甲、乙是两种单质.这些化合物和单质之间存在如下的关系:
A、B、C是在中学化学中常见的三种化合物,它们各由两种元素组成,甲、乙是两种单质.这些化合物和单质之间存在如下的关系:据此判断:
(1)在A、B、C这三种化合物中,必定含有乙元素的是
(2)单质乙必定是
(3)单质乙的分子式可能是
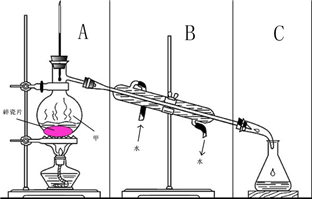 如图所示装置在中学化学实验中常用物质的分离与提纯
如图所示装置在中学化学实验中常用物质的分离与提纯(1)仪器甲的名称是
(2)上图存在一处错误,请指出存在错误的区域
(3)图中错误改正后,该装置可完成下列那个实验
A.除去CO2气体中混有的少量HCl气体
B.从硝酸钾和氯化钠的混合物提取硝酸钾
C.用含有Fe3+的自来水获得少量纯净的水.
Ⅰ下列实验操作或事故处理中,正确的做法是
A.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
B.在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒
C.配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高
D.配制FeCl3溶液时,将FeCl3固体溶于较浓盐酸中,然后再用水稀释到所需的浓度E.在铁粉存在下用溴水和苯反应制取溴苯时,无需加热
F.取1mL 20%蔗糖溶液,加入适量稀硫酸,水浴加热约5min后,再加入少量新制的Cu(OH)2,悬浊液加热,可检验蔗糖是否发生了水解
G.物质溶于水的过程中,一般有放热或吸热现象,若热效应不明显,溶解的操作可以在量筒中进行
Ⅱ在中学化学实验中,通常用无水硫酸铜来检验少量水的存在,然而,无水硫酸铜的吸湿性很强,需要时须现制现用.
方法Ⅰ:取2药匙细小的硫酸铜晶体置于
方法Ⅱ:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干.
【交流与讨论】
(1)方法Ⅰ中,加热温度稍高时会出现变黑现象,原因是
(2)方法Ⅱ中,浓硫酸的作用是
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想
查看习题详情和答案>>
BCD
BCD
A.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
B.在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒
C.配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高
D.配制FeCl3溶液时,将FeCl3固体溶于较浓盐酸中,然后再用水稀释到所需的浓度E.在铁粉存在下用溴水和苯反应制取溴苯时,无需加热
F.取1mL 20%蔗糖溶液,加入适量稀硫酸,水浴加热约5min后,再加入少量新制的Cu(OH)2,悬浊液加热,可检验蔗糖是否发生了水解
G.物质溶于水的过程中,一般有放热或吸热现象,若热效应不明显,溶解的操作可以在量筒中进行
Ⅱ在中学化学实验中,通常用无水硫酸铜来检验少量水的存在,然而,无水硫酸铜的吸湿性很强,需要时须现制现用.
方法Ⅰ:取2药匙细小的硫酸铜晶体置于
研钵
研钵
中研碎后放入坩埚,将坩埚放在泥三角上用小火慢慢加热并用玻璃棒不停搅拌,最后将坩埚移入干燥器
干燥器
中进行冷却.方法Ⅱ:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干.
【交流与讨论】
(1)方法Ⅰ中,加热温度稍高时会出现变黑现象,原因是
CuSO4?5H2O
CuO+SO3+5H2O或CuSO4?5H2O
CuO+H2SO4+4H2O也可
| ||
| ||
CuSO4?5H2O
CuO+SO3+5H2O或CuSO4?5H2O
CuO+H2SO4+4H2O也可
(用化学方程式表示).
| ||
| ||
(2)方法Ⅱ中,浓硫酸的作用是
吸水剂
吸水剂
;为了不浪费药品,对无水乙醇洗涤液进行再生的方法是加CaO后蒸馏
加CaO后蒸馏
,所用的主要玻璃仪器有烧瓶、接液管、锥形瓶、酒精灯、冷凝管
冷凝管
等.(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想
铜离子对双氧水分解有催化作用
铜离子对双氧水分解有催化作用
.