0.1000mol/LNaOH标准溶液;
100mL容量瓶,10ml移液管,碱式滴定管,铁架台,滴定管夹,锥形瓶,烧杯,酸碱指示剂(可供选用的有:甲基橙,酚酞,石蕊)。
[实验步骤]
① 配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中。
② 盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。
③ 滴定
往盛有待测食醋溶液的锥形瓶中滴加某酸碱指示计2-3滴,滴定至终点。记录NaOH的终读数。重复滴定3次。
[数据记录]
|
滴定次数 实验数据 |
1 |
2 |
3 |
4 |
|
V(样品)/mL |
20.00 |
20.00 |
20.00 |
20.00 |
|
V (NaOH)始/mL |
0.00 |
0.20 |
0.10 |
0.10 |
|
V (NaOH)终/mL |
14.98 |
15.20 |
15.12 |
16.24 |
[问题与思考]
⑴ 步骤①中中还需补充的仪器有 ▲ 。蒸馏水的处理方法是 ▲ 。
⑵ 步骤③中你选择的酸碱指示剂是 ▲ ,理由是 ▲ 。
⑶ 若用深色食醋进行实验,为准确判断滴定终点,可采取的措施是 ▲ 。
⑷ 样品总酸量= ▲ g/100mL。
18.(10分)钛在地壳中的含量比铜多61倍,排第十位。钛及其化合物大量应用于航空、造船、电子、化学、医疗器械、电讯器材等各个领域。
⑴ 由钛铁矿(FeTiO3)提取金属钛(海绵钛)的主要工艺过程如下(部分产物省略):

上述熔炼过程发生的反应为吸热反应,该反应能够自发进行的原因是 ▲ ;还原过程必须在1070K的温度下进行,你认为还应该控制的反应条件是 ▲ 。
⑵ 用浓硫酸处理钛铁矿,并向所得溶液中加入铁,此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
|
氢氧化物 |
Fe(OH)2 |
TiO(OH)2 |
Mg(OH)2 |
|
Ksp |
8.0×10-16 |
1.0×10-29 |
1.8×10-11 |
常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于 ▲ 时,Mg(OH)2开始沉淀。
 若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
白色沉淀,写出该反应的离子方程式: ▲ 。
⑶ BaTiO3是一种可用来吸收低频波的无机功能材料。工业上,常用
BaCl2、TiCl4、H2O和H2C2O4混合反应生成白色固体A,将该白色
固体加热分解至900K可得BaTiO3,实验测得其热分解过程的质量
-温度关系曲线如右图所示,图中400K、600K和900K时对应的
样品的质量分别为8.38mg、5.68mg和5.19mg。白色固体A的化学式
为 ▲ (填序号)。
a.BaTi2O5 b.BaC2O4·2H2O c.BaTi(C2O4)3 d.BaTiO (C2O4)2·4H2O
17.(10分)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
① CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+206.1 kJ/mol
CO(g)+3H2(g) ΔH1=+206.1 kJ/mol
② CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH2=+247.3
kJ/mol
2CO(g)+2H2(g) ΔH2=+247.3
kJ/mol
③ CO(g)+H2O(g) CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
请回答下列问题:
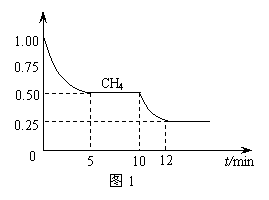
⑴ 在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示。反应进行的前5 min内, v(H2)= ▲ ;10 min时,改变的外界条件可能是 ▲ 。


⑵ 如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。


⑶ 反应③中ΔH3= ▲ 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
|
CO |
H2O |
CO2 |
H2 |
|
0.5 mol |
8.5 mol |
2.0 mol |
2.0 mol |
此时反应③中正、逆反应速率的关系式是 ▲ (填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
 ,具有抗癌作用;反铂的结构式为
,具有抗癌作用;反铂的结构式为 ,无抗癌作用。
,无抗癌作用。
 ① 部分链状葡萄糖分子在水溶液中通过分子内加成反应,以六元环或五元环的形式存在,其中六元环
① 部分链状葡萄糖分子在水溶液中通过分子内加成反应,以六元环或五元环的形式存在,其中六元环
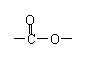 ⑵ B的结构简式是 ▲ ,反应②的类型是 ▲ 。
⑵ B的结构简式是 ▲ ,反应②的类型是 ▲ 。