|
 |
|
V V V
然后把两个容器中的物质压缩到一个容器中去,而对于2SO2+O2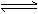 2SO3(g) ,压缩,平衡右移,故SO2的转化率增大。正确答案为B.
2SO3(g) ,压缩,平衡右移,故SO2的转化率增大。正确答案为B.  练习2:在一定温度下,向一个容积固定的密闭真空容器中充入2molX气体,发生反应X(g)
练习2:在一定温度下,向一个容积固定的密闭真空容器中充入2molX气体,发生反应X(g)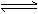 Y(g)+Z(g),使反应达到平衡,这时容器中的混合气体中X气体的体积分数是a%. 若在同一容器中,最初放入的是1 molY 和1 molZ 的混合气体,并在相同的温度下使反应达到平衡,这时混合气体中 X 气体所占的体积分数是b% 。则 a 和b 的关系是(
)
(A)
a>b (B)
a=b (C)
a<b (D) 2a=b
(参考答案为A. )
Y(g)+Z(g),使反应达到平衡,这时容器中的混合气体中X气体的体积分数是a%. 若在同一容器中,最初放入的是1 molY 和1 molZ 的混合气体,并在相同的温度下使反应达到平衡,这时混合气体中 X 气体所占的体积分数是b% 。则 a 和b 的关系是(
)
(A)
a>b (B)
a=b (C)
a<b (D) 2a=b
(参考答案为A. )
 在反应:2A+B 3C+4D中,所表示的反应速率最快的是 ( )
在反应:2A+B 3C+4D中,所表示的反应速率最快的是 ( )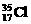 和
和 若知平均相对原子质量,求二者个数比或某一种的丰度,学生很熟,若改问求
若知平均相对原子质量,求二者个数比或某一种的丰度,学生很熟,若改问求
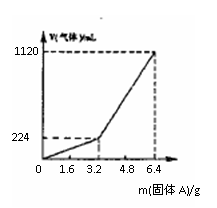 例2.将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300 mL 2 mol·L-1盐酸中使之完全溶解。测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。
例2.将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300 mL 2 mol·L-1盐酸中使之完全溶解。测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。