摘要:例1.某工业反应混合液中仅可能含有的组分是乙醚C4H10O.乙醇C2H6O和水.经分析液体中各原子数之比C:H:O=16:42:5.若混合液中只含两种组分.则可能的组合是 A.乙醚和乙醇 B.乙醚和水 C.乙醇和水 D.乙醛和丁醇 分析:平均组成为C3.2H 8.4O 选项A 所以选项A符合.同理选B.特别注意D.碳氢原子比例不相符.所以不能选. 例2.将2 mol NaHCO3和一定量的Na2O2固体混合.在加热条件下使其充分反应.经测定反应后Na2O2无剩余.则最后所得固体的物质的量为 A.1 mol ~ 2 mol之间 B.1 mol ~ 4 mol之间 C.1 mol ~ 6 mol之间 D.大于4 mol 分析:2 mol NaHCO3受热完全分解.生成1mol Na2CO3同时放出1molCO2和1molH2O.若Na2O2没有.则所得固体至少为1mol.若Na2O2足量.保证放出的CO2和水蒸气与其恰好反应.则所得固体至多为4mol.所以选B. 例3.碳酸铜和碱式碳酸铜[Cu2(OH)2CO3]均能溶于盐酸.转化为氯化铜.在高温下这两种化合物均能分解生成氧化铜.溶解28.4g上述混合物恰好消耗1mol/L盐酸500mL.灼烧等量的上述混合物.得到的氧化铜质量是( ). A. 35g B. 30g C. 20g D. 15g [评析]审题的第四项要求是增强思维的灵活性.就是审题达到化繁为简.弃劣扬优.推陈出新.优化解题思路.解题过程.启迪心智.拓展思维.本题若从守恒的角度.可以一步得解.n(CuO)=n(Cu2+)=n(Cl-)/2=n=20g.C.
网址:http://m.1010jiajiao.com/timu3_id_53677[举报]
某工业反应混合液中仅可能含有的组分是:乙醚(C4H10O)、乙醇(C2H6O)和水.经分析,液体中C、H、O原子数之比为16∶42∶5.
(1)若混合液中只含两种混合,则所有可能的组合是:___________.
(2)若混合液中含有3种组分,在628 g混合液中有1 mol H2O,此时乙醇和乙醚的物质的量各是多少?
查看习题详情和答案>>
某工业反应混合液中仅可能含有的组分是:乙醚(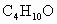 )、乙醇(
)、乙醇(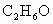 )和水.经分析,液体中各原子数之比为C∶H∶O=16∶42∶5.
)和水.经分析,液体中各原子数之比为C∶H∶O=16∶42∶5.
(1)若混合液中只含两种组分,则所有可能的组合是______________________。
(2)若混合液中含有三种组分,在628g混合液中有1mol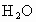 ,此时乙醇和乙醚的物质的量分别为________mol和_________mol.
,此时乙醇和乙醚的物质的量分别为________mol和_________mol.
某工业反应混合液中仅可能含有的组分是:乙醚(C4H10O)、乙醇(C2H6O)和水.经分析,液体中C、H、O原子数之比为16∶42∶5.
(1)若混合液中只含两种混合物组分,则所有可能的组合是:________.
(2)若混合液中含有三种组分,在628 g混合液中有1 mol H2O,此时乙醇和乙醚的物质的量各是多少?