11.(14分)将水蒸汽和CO气体分别通入到体积为1 L的恒容密闭容器中进行反应。
H2O(g)+CO(g) CO2(g)+H2(g);DH。得到以下三组数据,据此回答下列问题:
CO2(g)+H2(g);DH。得到以下三组数据,据此回答下列问题:
|
|
|
起始量 |
平衡量 |
|
||
|
实验组 |
温度 |
H2O |
CO |
H2 |
CO2 |
达到平衡所需时间 |
|
l |
650℃ |
1 mo1 |
2 mol |
0.8 mol |
0.8 mol |
5 min |
|
2 |
900℃ |
0.5 mo1 |
l mo1 |
0.2 mo1 |
0.2 mol |
3 min |
|
3 |
900℃ |
amol |
bmo1 |
cmo1 |
dmol |
t |
(1)由以上数据,实验l中以v(CO2)表示的反应速率为 mol/(L×min)。
(2)比较该反应实验1和实验2中CO的转化率:α1 α2;该反应的反应热DH 0。
(两空填“>”、“=”或“<”)
(3)若实验3要达到与实验2等效的平衡状态,且t< 3 min,则a、b应满足的关系是
(4)900°C时,若要重新达到平衡,使c(CO2)/c(CO)比值变小,在其他条件不变时,可
采取的措施有(填字母)
A.使用高效催化剂 B.增大H2浓度 C.升高温度 D。缩小容器体积
9.(14分)有四种短周期元素Y、M、Z、X,其原子序数依次增大,其微粒结构或性质特点如下表:
|
元素编号 |
元素微粒结构或性质特点 |
|
x |
标准状况下X2的密度为3.17 g/L |
|
Y |
原子最外层电子数为次外层电子数的2倍 |
|
Z |
最高价氧化物E是通讯材料光导纤维的主要原料 |
|
M |
0.l mol/L M的最高价氧化物的水化物N的水溶液pH=13 |
(1)M离子的离子结构示意图为: ;
(2)Y形成一种可用作装饰品的单质,其晶体的熔点与Z单质比较,熔点较高的是
(填化学式),Z最高价氧化物晶体类型是 。
(3)写出N与X2单质反应的离子方程式:
(4)以石墨和铁作电极,用电解槽电解化合物MX的水溶液,阳极产生X2,铁应
作 极,若该电极逸出1.12 L(标准状况)气体,则电路中转移电子 mol。
8.室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合前后的体积变化)( )
|
|
① |
② |
③ |
④ |
|
pH |
12 |
12 |
2 |
2 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH均增大
B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C.把①、④两溶液等体积混合后所得溶液中:c(C1-)>c(NH4+)>c(OH-)>c(H+)
D.熔溶液②和溶液③等体积混合,混合后所得溶液pH=7
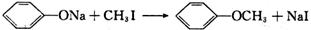 (3)已知:
(3)已知:
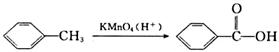


 右图是778K时N2与H2反应过程中能量变化的曲线图,
右图是778K时N2与H2反应过程中能量变化的曲线图, 2NH3为吸热反应
2NH3为吸热反应 6.右图中,两电极上发生电极反应。a极:Cu2++2e-=Cu,b极:Fe-2e-==Fe2+下列说法不正确的是( )
6.右图中,两电极上发生电极反应。a极:Cu2++2e-=Cu,b极:Fe-2e-==Fe2+下列说法不正确的是( )