3.(适用新课标)反应Fe(s)+CO2(g)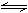 FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)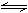 FeO(s)+H2(g)的平衡常数为K2。在不同温度下K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。在不同温度下K1、K2的值如下表:
|
温度/K |
K1 |
K2 |
|
973 |
1.47 |
2.38 |
|
1173 |
2.15 |
1.67 |
(1)试推导反应CO2(g)+H2(g)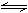 CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:
。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:
。
(2)通过K值的计算来判断,反应CO2(g)+H2(g)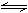 CO(g)+H2O(g)是 反应。(填“吸热”或“放热”)
CO(g)+H2O(g)是 反应。(填“吸热”或“放热”)
(3)在一体积为10 L的密闭容器中,加入一定量的CO2和H2O(g),在1173K时发生反应并记录反应前5min的浓度,第6min时改变了反应的条件,引起浓度的变化。各物质的浓度变化(mol/L)见下表:
|
时间/min |
CO2 |
H2 |
CO |
H2O |
|
0 |
0.2000 |
0.3000 |
0 |
0 |
|
2 |
0.1740 |
0.2740 |
0.0260 |
0.0260 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
|
|
5 |
0.0727 |
0.1727 |
0.1273 |
0.1273 |
|
6 |
0.0350 |
0.1350 |
0.1650 |
|
|
①前2min,用CO表示的该化学反应的速率是

②在3min-4min之间,反应处于
状态 (填“平衡”或“非平衡”)
(填“平衡”或“非平衡”)
③第6min时,平衡向 方向移动,可能的原因是

化学的学习过程中常用的科学思维方法有分析与综合、比较与分类、抽象与概括等,此外还要掌握类比、假说、建立模型等科学的推理方法,作为选拔高一级人才的高考化学试题,理应加强对学生综合思维能力的考查。
例4. 工业上生产Na、Ca、Mg都用电解其熔融态的氯化物,但K却不能用电解熔融KCl的方法来制取,因为金属钾易溶于熔态的KCl中而有危险,难以获得钾,且降低电流效率。工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:Na (l)+KCl (l)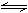 NaCl (l)+K(g)
△H>0,各物质的有关数据如下表:
NaCl (l)+K(g)
△H>0,各物质的有关数据如下表:
|
物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm3 |
|
Na |
97.8 |
883 |
0.97 |
|
K |
63.7 |
774 |
0.86 |
|
NaCl |
801 |
1465 |
2.165 |
|
KCl |
770 |
1437 |
1.984 |
(1) 工业上制取金属钾的化学原理是 ,在常压下金属钾转为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是 。
(3)常压下,将反应温度升高到900℃时,该反应的平衡常数可以表示为
K= 。
解析:由题中信息知,工业上冶炼金属钾的化学原理是化学平衡移动原理,反应控制的温度范围应至少大于金属钾的沸点,而小于金属钠的沸点。(当然也不高于KCl、NaCl的沸点);在制备钾的过程中,为提高原料的利用率,即想法使反应向右移动,所以可采取的措施有:适当的升高温度、降低压强或移去钾蒸气。(3)在900℃时,反应方程式中物质Na也为气态,故此时的平衡常数K=c(K)/c(Na)。
答案:(1)化学平衡移动原理 774℃ 883℃
(2)适当的升高温度、降低压强或移去钾蒸气 (3)c(K)/c(Na)
[点评]:本题以冶炼金属钾这一新的知识点来考查学生的综合思维能力,要求同学在解答试题时以化学平衡移动原理为依据,以演绎推理为判据,用合成氨等平衡移动的应用为思维原型进行类比推理,形成思维迁移的起点。望同学们深刻领悟此题的考查意境和解答方法。
能力训练:
1.已知反应:3A(g)+B(g)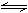 2C(g) △H<0。现向甲容器中充入3molA和1molB,向乙容器中充入a
molC,若初始时两容器的温度、体积都相同,且甲容器能保持恒温恒压、乙容器能保持恒温恒容。则反应一段时间后,两容器中A的物质的量分数相同,下列说法中正确的是
(
)
2C(g) △H<0。现向甲容器中充入3molA和1molB,向乙容器中充入a
molC,若初始时两容器的温度、体积都相同,且甲容器能保持恒温恒压、乙容器能保持恒温恒容。则反应一段时间后,两容器中A的物质的量分数相同,下列说法中正确的是
(
)
A.a<2 B.a=2,并增大甲的压强
C.a>2 D.a=2,并降低乙的温度
(二)在一固定体积的密闭容器中,充入2molCO2和1molH2发生下列化学反应:CO2(g)+H2(g)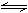 CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
|
T/℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)若反应在830℃下达到平衡,则CO2气体的转化率为 。
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度 。(填“升高”、“降低”或“不能确定”)
(4)能判断该反应是否达到化学平衡状态的依据是 。
A. 容器内压强不变 B. 混合气体中[CO]不变
C. v正(H2)= v逆(H2O) D. c(CO2)=c(CO)
E. [CO2]·[H2]=[CO]·[H2O]
解析:(一)利用化学平衡常数K的意义知:K值越大,则表示反应进行的越完全;因不能确定反应的热效应,升温不能确定反应的移动方向,所以温度升高时,K值可能增大也可能减小。
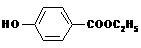 ,其生产过各如下图根据上图
,其生产过各如下图根据上图
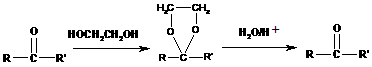
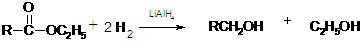
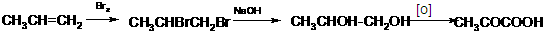
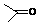 也可与H2加成,故必须考虑将该官能团加以掩蔽和保护,最后重新将其 “复原”,这可以利用信息反应(2)的方法而达到目的。从而易写出合成 CH3-CO-CH20H的有关反应方程式如下
也可与H2加成,故必须考虑将该官能团加以掩蔽和保护,最后重新将其 “复原”,这可以利用信息反应(2)的方法而达到目的。从而易写出合成 CH3-CO-CH20H的有关反应方程式如下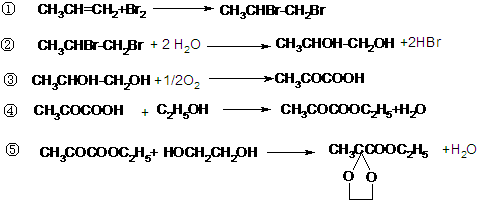
 (2)33.3% (3) 降低 (4)b c
(2)33.3% (3) 降低 (4)b c 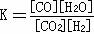 ;(2)利用“平衡‘三段式’法”,结合化学平衡常数的表达式可以求出反应在830℃下达到平衡时CO2气体的物质的量,进而求出CO2气体的转化率为:33.3%;(3)利用表中数据:升温,K值增大,说明反应是吸热反应,所以在绝热条件下,平衡发生移动的结果是使容器内CO的浓度增大,即平衡正向移动,吸收热量,故容器内气体温度降低;(4)因该反应反应前后气体物质的量不变,故压强不能用来判断是否达到平衡状态的标志,选项B、C由平衡状态特征及本质可知可作为判断反应达到化学平衡状态的依据;选项C、D与平衡状态无直接关系。
;(2)利用“平衡‘三段式’法”,结合化学平衡常数的表达式可以求出反应在830℃下达到平衡时CO2气体的物质的量,进而求出CO2气体的转化率为:33.3%;(3)利用表中数据:升温,K值增大,说明反应是吸热反应,所以在绝热条件下,平衡发生移动的结果是使容器内CO的浓度增大,即平衡正向移动,吸收热量,故容器内气体温度降低;(4)因该反应反应前后气体物质的量不变,故压强不能用来判断是否达到平衡状态的标志,选项B、C由平衡状态特征及本质可知可作为判断反应达到化学平衡状态的依据;选项C、D与平衡状态无直接关系。 例2.在一定温度下,发生可逆反应:2A(g)+2B(g)
例2.在一定温度下,发生可逆反应:2A(g)+2B(g)