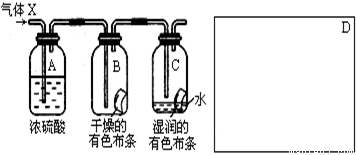摘要:4.克服思维定势的消极作用避开“陷阱 人们往往习惯用固定了的思维模式去解决问题.命题人根据同学们的这一弱点.常常在命题中偷梁换柱或弱化信息巧设“陷阱 . 例1 100g98%的浓硫酸中含氧原子个数约为( ). A.6.02×1023 B.4×6.02×1023 C.4.11×6.02×1023 D.4 分析 该题很多同学受思维定势的影响.只考虑H2S04分子中的O原子.却没有考虑到水中同样含有O原子.而掉进了“陷阱 .错选选项B.本题正确答案应为C. 例2 在①NH4NO3中氮元素显+5价, ②4FeS2+11O2====2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化, ③氧化还原反应中还原剂得电子数与氧化剂失电子数一定相等. 这3种说法中错误的是( ). A.① B.②③ C.①③ D.①②③ 分析 该题也容易受思维定势的影响.NH4NO3中氮元素显+5价和-3价.而②.③中铁元素和硫元素被氧化.氧化还原反应中得.失电子数相等.已成了不变的事实.所以错选人其实若仔细审题就会看出.②中的硫元素并不是-2价.而是-1价.③中的还原剂也不是得电子.氧化剂也不是失电子.而应是还原剂失电子.氧化剂得电子.因此在解题中要注意这种张冠李戴的错误.该题正确答案为D. 例3.将pH为5的硫酸溶液稀释500倍.稀释后溶液中c (SO42-):c (H+)约为 A.1:1 B.1:2 C.1:10 D.10:1 分析:根据定量计算.稀释后CH+=2×10-8mol·L-1.CSO42-=10-8.有同学受到思维定势.很快得到答案为B.其实.题中设置了酸性溶液稀释后.氢离子浓度的最小值不小于1×10-7mol·L-1.所以.此题稀释后氢离子浓度只能近似为1×10-7mol·L-1.所以.选C. 例4.将a g Fe.Mg合金溶解在一定量的稀硝酸中.当合金完全溶解后.收集到标准状况下的NO气体bL(设HNO3的还原产物只有NO).再向反应后的溶液中加入足量NaOH溶液.得到沉淀物.若用守恒法求沉淀的质量.用到的守恒关系依次是 A.质量守恒.电子守恒.电荷守恒 B.电子守恒.质量守恒.电荷守恒 C.电子守恒.电荷守恒.质量守恒 D.电荷守恒.质量守恒.电子守恒 分析:这道试题对能力要求比较高.涉及到的化学基础知识比较多.假设反应后.Fe2+ x mol,Fe3+ y mol ,Mg2+ z mol, 根据电子守恒得2x+3y+2z=b/22.4×3.根据电荷守恒得2x+3y+2z=nOH-.所以根据质量守恒沉淀的质量为合金的质量加上氢氧根离子的质量.所以沉淀质量为g.
网址:http://m.1010jiajiao.com/timu3_id_53674[举报]
2012年10月29日,超强飓风“桑迪”登陆美国东海岸,给人们的生命财产造成巨大损失.灾区人们的饮水必须用漂白粉等药品消毒后才能饮用,以防止传染病发生.
(1)试用化学方程式表示工业制取漂白粉的过程:
(2)已知浓盐酸和漂白粉中的成分之一次氯酸钙能发生如下反应:
Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是
①CO2 ②HCl ③H2O ④O2
A.①②③B.②③④C.②③D.①④
(3)某学生应用如图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.回答下列问题:
①该项研究(实验)的主要目的是
②浓H2SO4的作用是
③这样的实验设计还存在事故隐患,请在图中的D处画出能克服该缺陷的装置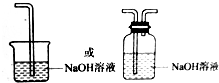
 .
.
查看习题详情和答案>>

(1)试用化学方程式表示工业制取漂白粉的过程:
2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
(2)已知浓盐酸和漂白粉中的成分之一次氯酸钙能发生如下反应:
Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是
A
A
.①CO2 ②HCl ③H2O ④O2
A.①②③B.②③④C.②③D.①④
(3)某学生应用如图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.回答下列问题:
①该项研究(实验)的主要目的是
比较Cl2和HClO谁有漂白性
比较Cl2和HClO谁有漂白性
;②浓H2SO4的作用是
吸收气体中的水蒸汽
吸收气体中的水蒸汽
,与研究目的直接相关的实验现象是B中的布条不褪色,C中的布条褪色
B中的布条不褪色,C中的布条褪色
;③这样的实验设计还存在事故隐患,请在图中的D处画出能克服该缺陷的装置


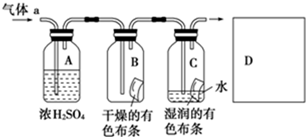 甲同学设计如图所示装置研究氯气能否与水发生反应.气体a的主要成分是含有少量空气和水蒸气的氯气.
甲同学设计如图所示装置研究氯气能否与水发生反应.气体a的主要成分是含有少量空气和水蒸气的氯气.请回答下列问题:
(1)浓硫酸的作用是
除去氯气中的水蒸气,干燥氯气
除去氯气中的水蒸气,干燥氯气
.(2)证明氯气和水反应的实验现象为
装置B中的有色布条不褪色,装置C中的有色布条褪色
装置B中的有色布条不褪色,装置C中的有色布条褪色
.(3)从物质性质的方面来看,这样的实验设计存在的缺陷为
没有尾气吸收装置
没有尾气吸收装置
,请用离子方程式表达图中D框克服事故隐患的措施Cl2+2OH-=Cl-+ClO-+H20
Cl2+2OH-=Cl-+ClO-+H20
.(10分)某学生应用下图所示的装置来研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气。
回答下列问题:
(1)该项研究(实验)的主要目的是 。
(2)浓H2SO4的作用是 ,
与研究目的直接相关的实验现象是______________________________________。
(3)该实验装置设计上存在的缺陷为 _________________ ,
请在上图的D处画出能克服该缺陷的装置。
查看习题详情和答案>>
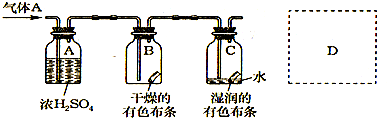
某生应用下图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气。
回答下列问题:
(1)该项研究(实验)的目的是_________________________________________。
(2)浓H2SO4的作用是_______________________________________________。
与研究目的直接相关的实验现象是_____________________________________________。
(3)从物质的性质方面看,这套设计还存在隐患,事故表现是____________________。
请在图中的虚线框内以图的形式表明克服事故隐患的措施。
查看习题详情和答案>>