19.化学兴趣小组在实验中发现:将锌粒放入CuSO4溶液中一段时间,锌粒表面附着了一层松散的黑色粉末状物质,而不是预期的红色物质。通过查阅资料秀讨论,大家认为黑色物质可能由Cu、CuO和Zn组成。同学们以黑色物质进行探究。
Ⅰ.小组成员认为黑色物质中含有氧化铜,是反应过程中生成的Cu(OH)2分解产生的。请说明反应过程中产生Cu(OH)2的原因_______________________________________。
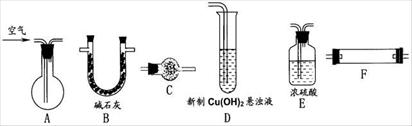
Ⅱ.兴趣小组对黑色粉末状物质的组成进行了实验探究。请完成下列实验报告。
限定实验仪器与试剂:1 g 黑色粉末、试管、玻璃棒、药匙、滴管、酒精灯、试管夹、稀H2SO4、浓HNO3、稀NaOH溶液、蒸馏水。
实验报告
(1)实验课题:探究黑色粉末的组成
(2)设计实验方案(不要在答题卡上作答)
(3)实验过程
|
实验操作 |
预期现象与结论 |
|
|
|
(4)实验讨论:根据以上探究结果,如果在锌与CuSO4溶液的知识中获得预期的红色物质,改进的方法是
___________________________________________________。
17.下列实验报告中,完全正确的是C
|
序号 |
实验操作 |
现象 |
结论 |
|
A |
向溶液中滴加用盐酸酸化的BaCl2溶液 |
有白色沉淀 |
原溶液中含SO42- |
|
B |
向溶液中滴加氯水后,再滴入KSCN溶液 |
溶液变红色 |
原溶液中含Fe3+ |
|
C |
向装有Na2O2的试管中加入水后,立即滴加酚酞试液 |
溶液先变红后褪色 |
Na2O2有漂白性 |
|
D |
向淀粉溶液中加入稀硫酸加热后,加入新制Cu(OH)2,加热 |
得到蓝色溶液 |
淀粉没有水解 |


 HCO3-+OH-或 HCO3-+H2O
HCO3-+OH-或 HCO3-+H2O (2分)
(2分)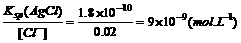
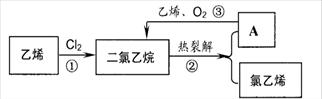
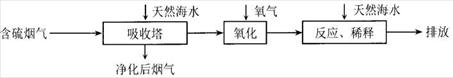
 2CO2(g) + N2(g) △H=-746.4kJ/mol 。起始反应时NO和CO各为4mol,10秒钟后达到化学平衡,测得N2为1mol。下列有关反应速率的说法中,正确的是C
2CO2(g) + N2(g) △H=-746.4kJ/mol 。起始反应时NO和CO各为4mol,10秒钟后达到化学平衡,测得N2为1mol。下列有关反应速率的说法中,正确的是C