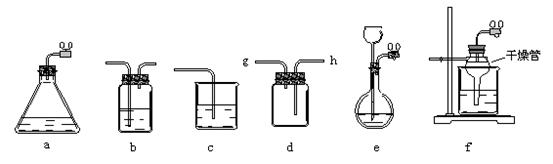
6、(15分)某化学课外活动小组利用下面所提供的仪器装置和药品制取NaHCO3溶液。
药品:①2%NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4
⑥CaCO3固体 ⑦K2CO3粉末
仪器装置:
请回答下列问题:
(1) 若利用装置a制取气体,生成气体的反应应具备的条件是___________________
______________________________________。
(2)有同学认为利用装置d可以收集H2、NH3、CO2等气体。但不能收集CO和NO气体的理由是__________________________________________________________________。
收集H2、NH3,气体由________口进。若要收集CO和NO气体,只要简单改进(不更换仪器)即可完成,其改进方法是______________________。
(3)请按下表要求,填写选择的装置和药品。
 
|
CO2发生装置(随开随用,随关随停)(X) |
除杂洗气装置(Y) |
制备产品装置(Z) |
|
选择的装置(填序号) |
|
|
c |
|
选择的药品(填序号) |
|
|
① |
(4)如何检验所选择的CO2发生装置(X)的气密性,请写出主要操作过程:____________
_____________________________________________________________________________________________________________________________________________。
(5)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生反应的离子方程式为_________________________________。
(6)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其原因是_____________________
_____________________________________________________。
5、(13分)三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是_____________________________________________。
(2)若滴入KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?___________。简述你的理由___________________________________
_______________________________________________________________________。
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是_______________________,写出发生反应的离子方程式_________________________
_________________________________________________________________________。
探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为__________________。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知在溶液中通过调节溶液的酸碱性而使Cu2+、Fe3+、Fe2+分别生成沉淀的pH如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
实验有下列试剂可供选择:A、氯水 B、H2O2 C、NaOH D、Cu2(OH)2CO3
实验小组设计如下实验方案:
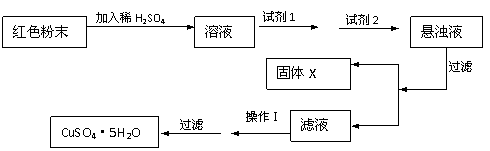
试回答:①试剂1为_______ 试剂2为__________ (填字母)
②固体X的化学式为________________ ③操作Ⅰ为_________________________。
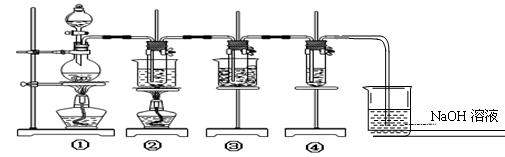
 (1)制取氯气时,通过分液漏斗向盛有二氧化锰固体的烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装
(填写化学试剂和装置名称);
(1)制取氯气时,通过分液漏斗向盛有二氧化锰固体的烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装
(填写化学试剂和装置名称);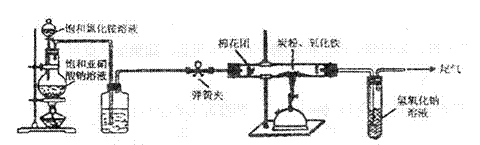
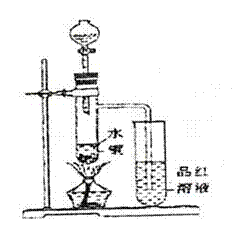 。(填“是”或“否”)
。(填“是”或“否”)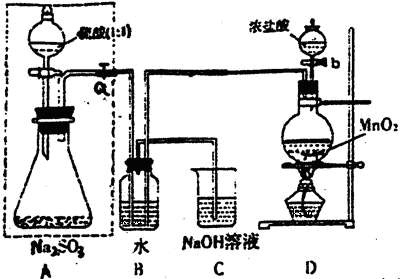
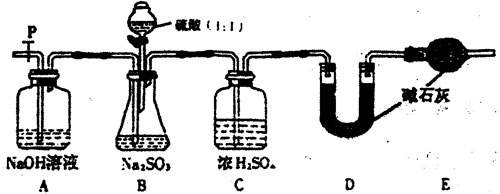
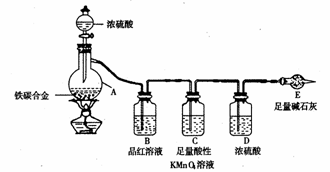
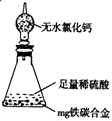 (7)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是__________(填写代号)。
(7)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是__________(填写代号)。 cC(g)+dD(g),取a mol A和b mol B置于V L容器中,1
min后,测得容器内A的浓度为x mol·L-1,这时B的浓度为 mol·
cC(g)+dD(g),取a mol A和b mol B置于V L容器中,1
min后,测得容器内A的浓度为x mol·L-1,这时B的浓度为 mol·