网址:http://m.1010jiajiao.com/timu3_id_48730[举报]

图1中:①为氯气发生装置;
②的试管里盛有15mL 30% KOH溶液,并置于水浴中;
③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;
④的试管里加有紫色石蕊试液;
⑤为尾气吸收装置.请填写下列空白:
(1)写出装置③发生的化学反应方程式
(2)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是:
A.NaBiO3 B.FeCl3 C.PbO2 D.Na2O2
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是①
(4)反应完毕经冷却后,②的试管中有大量晶体析出.图2、3中符合该晶体溶解度曲线的是
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性
(6)若②的试管溶液中不但有KClO3生成还有KClO生成,且二者的物质的量之比为1:2,则该反应中氧化剂和还原剂的物质的量之比为:

图中:①为氯气发生装置;②的试管里盛有15mL30%KOH 溶液.并置于水浴中; ③ 的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加人一定量的二氧化锰.通过________________(填写仪器名称)向烧瓶中加人适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在① 与② 之间安装盛有___________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:_______________________________
反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是________(填写编号字母);从②的试管中分离出该晶体的方法是________________(填写实验操作名称)

(3)本实验中制取次氯酸钠的离子方程式是:___________________________________________
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
实验现象 | 原因 |
溶液最初从紫色逐渐变为____色 | 氯气与水反应生成的H+使石蕊变色 |
随后溶液逐渐变为无色 | _______________________________________________ |
然后溶液从无色逐渐变为____色 | _______________________________________________ |
在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊
试液;⑤为尾气吸收装置。
请填写下列空白:
⑴ 制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸
⑵ 如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因:
①_______________________________________________,
②__________________________________________________________________________。
⑶ 比较制取氯酸钾和次氯酸钠的条件,二者的差异是
① ;
② 。
反应完毕经冷却后,②的试管中有大量晶体析出。下图
中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。

⑷ 实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白。
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______________________________________ |
| 然后溶液从无色逐渐变为_______色 | ______________________________________ |
在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊
试液;⑤为尾气吸收装置。
请填写下列空白:
⑴ 制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸
⑵ 如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因:
①_______________________________________________,
②__________________________________________________________________________。
⑶ 比较制取氯酸钾和次氯酸钠的条件,二者的差异是
① ;
② 。
反应完毕经冷却后,②的试管中有大量晶体析出。下图
中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
⑷ 实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白。
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______________________________________ |
| 然后溶液从无色逐渐变为_______色 | ______________________________________ |
查看习题详情和答案>>
在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。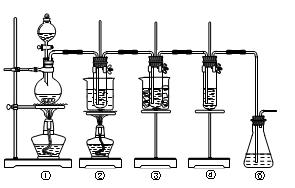
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊
试液;⑤为尾气吸收装置。
请填写下列空白:
⑴ 制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸
⑵ 如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因:
①_______________________________________________,
②__________________________________________________________________________。
⑶ 比较制取氯酸钾和次氯酸钠的条件,二者的差异是
① ;
② 。
反应完毕经冷却后,②的试管中有大量晶体析出。下图
中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
⑷ 实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白。
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______________________________________ |
| 然后溶液从无色逐渐变为_______色 | ______________________________________ |